Numero 5 di Lettere di Ortobiologia
PERINFECTIONS e PEROSSAL® NELLA CURA DELLE INFEZIONI OSSEE
INTRODUZIONE
I microorganismi che causano infezioni ossee si trovano in due forme di vita principali: planctonica e in forma di biofilm. I primi sono microorganismi flottanti, dal metabolismo attivo e dalla rapida replicazione; i secondi risiedono in complessi multicellulari tridimensionali avvolti da esopolisaccaridi, sono poco attivi metabolicamente e resistenti alle reazioni sia dell’ospite che degli agenti antimicrobici (Zimmerli & Sendi 2017). Le infezioni da biofilm sono pertanto molto difficili da diagnosticare ed eradicare ed è necessario abbinare alla terapia antimicrobica un trattamento chirurgico (Zimmerli & Sendi 2017).
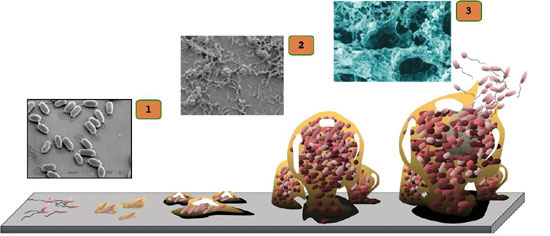
Le principali infezioni da biofilm nei pazienti ortopedici sono tre: osteomielite cronica, infezione articolare peri-protesica e osteomielite associata a osteosintesi in ossa lunghe (Zimmerli & Sendi 2017).
L’osteomielite è la maggiore complicazione nella chirurgia ortopedica ed è spesso associata al trattamento di fratture esposte, ricostruzioni ossee o impianti protesici (Vugt et al. 2016). Nonostante i progressi chirurgici e chemioterapici, l’osteomielite rimane difficile da trattare e non esiste un protocollo universalmente accettato per il loro trattamento (Dym & Zeidan 2017).
L’OSTEOMIELITE
L’osteomielite è un’infezione dell’osso con la presenza di un’infiammazione concomitante che coinvolge il midollo osseo e i tessuti circostanti e porta alla distruzione del tessuto osseo e dei tessuti circostanti (Lew & Waldvogel 1997; Lew & Waldvogel 2004; Vugt et al. 2016; Visani et al. 2018).
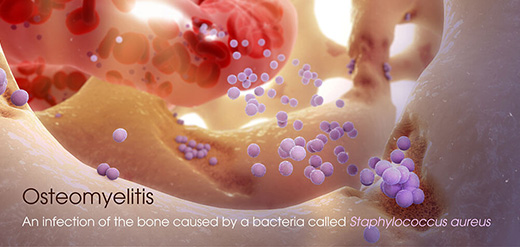
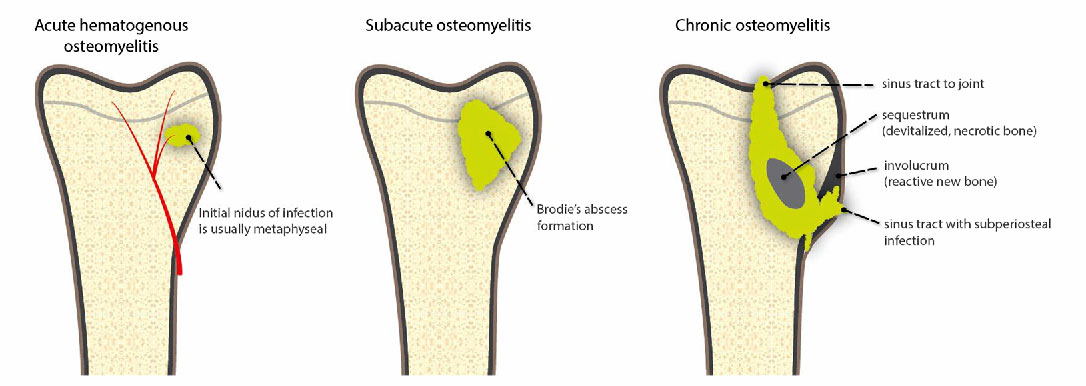
Dal punto di vista pratico le osteomieliti si possono dividere in tre tipologie: l’osteomielite ematogena, che si riscontra principalmente in bambini in età prepuberale e in pazienti anziani ed è caratterizzata da nidazione di batteri trasportati dal sangue all’interno dell’osso, a volte solo leggermente lesionato; l’osteomielite esogena, dovuta alla diffusione locale di un’infezione da una fonte contigua a causa di un trauma, un’operazione chirurgica o la sostituzione protesica di un’articolazione; l’osteomielite originata da insufficienza vascolare, soprattutto in pazienti diabetici, che porta ad un’infezione dei tessuti molli del piede che poi si diffonde alle ossa (Lew & Waldvogel 2004).
L’osteomielite ematogena è costituita da un’infezione che giunge all’osso attraverso il torrente circolatorio. Le regioni dell’osso maggiormente colpite dalle infezioni ematogene sono le metafisi delle ossa lunghe, soprattutto di omero, di femore e di tibia e si manifestano soprattutto nei bambini o negli adulti di età compresa tra i 50 e 70 anni. Questa tipologia di infezione provoca la formazione di sequestri ossei, una porzione di osso corticale della diafisi che, privata dell’apporto sanguigno dalla diffusione dell’infezione per via subperiostale, diventa densa e avascolare. Proprio a causa della sua natura avascolare, il sequestro agisce come un vero e proprio nido per la persistenza dell’infezione. Solitamente l’osteomielite ematogena è un’osteomielite acuta (Iannotti & Parker 2013).
L’osteomielite esogena -non ematogena- è causata dal diffondersi dell’infezione da un focolaio contiguo, da fratture esposte o in seguito a interventi chirurgici durante i quali l’osso viene perforato e contaminato. La contaminazione si annida nell’osso anche a causa della rimozione del supporto ematico dell’osso durante la chirurgia, che porta alla formazione di osso necrotico prima e di un sequestro poi. Questo causa la persistenza dell’infezione che può cronicizzarsi, persistendo finché il sequestro e il corpo estraneo non vengono rimossi.
Una delle più comuni cause di infezione ossea nell’adulto consiste nella combinazione di insufficienza vascolare e di immunodepressione che si riscontra nel diabete mellito. Nei pazienti diabetici il piede è particolarmente suscettibile alle ulcerazioni croniche della cute e alle infezioni secondarie del tessuto osseo. L’infezione esogena solitamente persiste a causa della presenza di detriti tessutali necrotici, tessuto osseo necrotico o di corpi estranei che fungono da nido per la continua proliferazione batterica. Una volta stabilita l’osteomielite esogena è molto difficile da eradicare e un trattamento efficace prevede il debridement chirurgico del focolaio osseo di infezione e la rimozione di corpi estranei infetti (Iannotti & Parker 2013).
Le osteomieliti acute sono spesso trattate con successo con terapia antibiotica sistemica, mentre le osteomieliti croniche richiedono quasi sempre un debridement chirurgico, il riempimento della cavità con un carrier a rilascio locale di antibiotico e la terapia antibiotica sistemica (Vugt et al. 2016; Dym & Zeidan 2017). Il sostituto osseo caricato con antibiotico per il rilascio locale controllato deve avere precise caratteristiche, deve essere: biocompatibile, biodegradabile e osteoconduttivo (Vugt et al. 2016).
L’osteomielite acuta si evolve in diversi giorni o settimane al contrario dell’osteomielite cronica che si evolve nel corso di mesi o anni, caratterizzata dalla persistenza di microorganismi, infiammazioni di basso grado, presenza di sequestri ossei e tratti fistolosi a livello cutaneo (Lew & Waldvogel 2004).
L’OSTEOMIELITE
L’osteomielite è un’infezione dell’osso con la presenza di un’infiammazione concomitante che coinvolge il midollo osseo e i tessuti circostanti e porta alla distruzione del tessuto osseo e dei tessuti circostanti (Lew & Waldvogel 1997; Lew & Waldvogel 2004; Vugt et al. 2016; Visani et al. 2018).
Dal punto di vista pratico le osteomieliti si possono dividere in tre tipologie: l’osteomielite ematogena, che si riscontra principalmente in bambini in età prepuberale e in pazienti anziani ed è caratterizzata da nidazione di batteri trasportati dal sangue all’interno dell’osso, a volte solo leggermente lesionato; l’osteomielite esogena, dovuta alla diffusione locale di un’infezione da una fonte contigua a causa di un trauma, un’operazione chirurgica o la sostituzione protesica di un’articolazione; l’osteomielite originata da insufficienza vascolare, soprattutto in pazienti diabetici, che porta ad un’infezione dei tessuti molli del piede che poi si diffonde alle ossa (Lew & Waldvogel 2004).
L’osteomielite ematogena è costituita da un’infezione che giunge all’osso attraverso il torrente circolatorio. Le regioni dell’osso maggiormente colpite dalle infezioni ematogene sono le metafisi delle ossa lunghe, soprattutto di omero, di femore e di tibia e si manifestano soprattutto nei bambini o negli adulti di età compresa tra i 50 e 70 anni. Questa tipologia di infezione provoca la formazione di sequestri ossei, una porzione di osso corticale della diafisi che, privata dell’apporto sanguigno dalla diffusione dell’infezione per via subperiostale, diventa densa e avascolare. Proprio a causa della sua natura avascolare, il sequestro agisce come un vero e proprio nido per la persistenza dell’infezione. Solitamente l’osteomielite ematogena è un’osteomielite acuta (Iannotti & Parker 2013).
L’osteomielite esogena -non ematogena- è causata dal diffondersi dell’infezione da un focolaio contiguo, da fratture esposte o in seguito a interventi chirurgici durante i quali l’osso viene perforato e contaminato. La contaminazione si annida nell’osso anche a causa della rimozione del supporto ematico dell’osso durante la chirurgia, che porta alla formazione di osso necrotico prima e di un sequestro poi. Questo causa la persistenza dell’infezione che può cronicizzarsi, persistendo finché il sequestro e il corpo estraneo non vengono rimossi.
Una delle più comuni cause di infezione ossea nell’adulto consiste nella combinazione di insufficienza vascolare e di immunodepressione che si riscontra nel diabete mellito. Nei pazienti diabetici il piede è particolarmente suscettibile alle ulcerazioni croniche della cute e alle infezioni secondarie del tessuto osseo. L’infezione esogena solitamente persiste a causa della presenza di detriti tessutali necrotici, tessuto osseo necrotico o di corpi estranei che fungono da nido per la continua proliferazione batterica. Una volta stabilita l’osteomielite esogena è molto difficile da eradicare e un trattamento efficace prevede il debridement chirurgico del focolaio osseo di infezione e la rimozione di corpi estranei infetti (Iannotti & Parker 2013).
Le osteomieliti acute sono spesso trattate con successo con terapia antibiotica sistemica, mentre le osteomieliti croniche richiedono quasi sempre un debridement chirurgico, il riempimento della cavità con un carrier a rilascio locale di antibiotico e la terapia antibiotica sistemica (Vugt et al. 2016; Dym & Zeidan 2017). Il sostituto osseo caricato con antibiotico per il rilascio locale controllato deve avere precise caratteristiche, deve essere: biocompatibile, biodegradabile e osteoconduttivo (Vugt et al. 2016).
L’osteomielite acuta si evolve in diversi giorni o settimane al contrario dell’osteomielite cronica che si evolve nel corso di mesi o anni, caratterizzata dalla persistenza di microorganismi, infiammazioni di basso grado, presenza di sequestri ossei e tratti fistolosi a livello cutaneo (Lew & Waldvogel 2004).

Osteomielite cronica
La cronicizzazione avviene spesso quando l’osteomielite non viene diagnosticata e trattata in tempi rapidi in caso di infezione profonda dei tessuti molli, come in pazienti con insufficienza vascolare, neuropatia periferica e ulcera da pressione sacrale (Zimmerli & Sendi 2017). Spesso i pazienti affetti da osteomielite cronica presentano comorbilità multiple, carenza di tessuti molli e microorganismi multi-resistenti (McNally et al. 2016).
In pazienti con patologia del piede diabetico l’osteomielite cronica ha origine secondaria da focus contiguo. Un’infezione non riconosciuta, associata ad un impianto, può progredire fino a cronicizzarsi in osteomielite anche dopo la rimozione della sintesi, soprattutto nel caso di fratture esposte trattate con un breve ciclo di antibiotici preventivi post impianto (Zimmerli & Sendi 2017).
Il principale fattore di distinzione tra un’osteomielite acuta e cronica è il tempo: un’osteomielite diventa cronica quando il ritardo tra infezione e trattamento efficace supera le 4-6 settimane. A livello cellulare la transizione da acuto a cronico avviene quando si passa da osso vivo infiammato a una quantità significativa di osteoblasti non vitali (Zimmerli & Sendi 2017).
L’osteomielite cronica è caratterizzata dalla presenza di osso sequestrato che crea un nido ideale per il radicamento dell’infezione e la formazione del biofilm (Ferguson et al. 2017). È il biofilm stesso a ridurre la vitalità degli osteoblasti e ad aumentare il riassorbimento osseo e a loro volta i sequestri ossei facilitano l’adesione batterica e la formazione del biofilm (Zimmerli & Sendi 2017).
L’osteomielite cronica può rimanere silente e asintomatica e ripresentarsi anche dopo alcuni decenni, dimostrando la persistenza del biofilm sui sequestri ossei. A causa di questo fattore, se l’età del biofilm supera il mese, la sua eliminazione mediante sola terapia antimicrobica sistemica non è più sufficiente e bisogna intervenire chirurgicamente (Zimmerli & Sendi 2017).
Trattamento chirurgico
In primis bisogna ripristinare un adeguato apporto di sangue, riaprendo i canali endomidollari, poi eseguire lo sbrigliamento dell’osso morto mediante sequestrectomia, resecare il tessuto danneggiato, infetto e fibroso, ripristinare un’adeguata copertura dei tessuti molli e infine gestire sia lo spazio morto sia la stabilità ossea (Zimmerli & Sendi 2017).
La procedura chirurgica di debridement per la rimozione di tutti i tessuti, osseo e molle, infetti ha anche l’effetto di spargere i batteri all’interno della cavità vuota che rimane. Tale cavità, se lasciata vuota, verrebbe riempita con un ematoma, creando un ambiente poco ossigenato con pH basso, che favorisce il propagarsi dei batteri in fase planctonica e lo sviluppo del biofilm (Ferguson et al. 2017). È quindi necessario utilizzare un carrier antibiotato che possa riempire il difetto osseo e rilasciare un’elevata concentrazione di antibiotico a livello locale, impedendo la ricolonizzazione batterica (Ferguson et al. 2017; Visani et al. 2018).
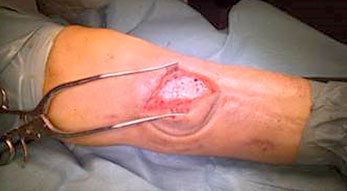
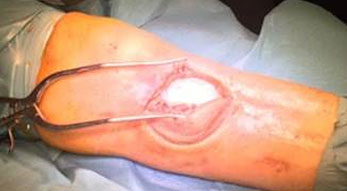
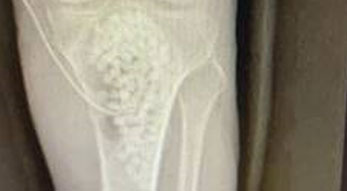
Osteomielite del piede diabetico
L’osteomielite del piede è molto comune in pazienti affetti da diabete mellito e circa il 10% di tutti i pazienti diabetici sviluppano un’ulcera del piede (Niazi et al. 2019). La maggior parte delle infezioni del piede si verificano in seguito a ulcere neuropatiche che fungono da ingresso per i patogeni. Spesso alla neuropatia sono associati anche problemi al sistema vascolare periferico, che non permettono la guarigione della ferita (Niazi et al. 2019). Il diabete è tra le principali cause di amputazione non traumatica degli arti, con conseguenti gravi comorbilità e un elevato rischio di mortalità (Niazi et al. 2019).
Il trattamento delle infezioni del piede diabetico è particolarmente difficile a causa delle resistenze multi-farmaco sviluppate dai patogeni, della scarsissima capacità di penetrazione nell’osso degli antibiotici utilizzati per via sistemica, della necessità di eseguire un profondo debridement chirurgico di tessuto osseo e tessuti molli ma anche dalla contemporanea necessità di conservarli il più possibile per non compromettere la funzionalità del resto del piede (Drampalos et al. 2018; Niazi et al. 2019).
L’osteomielite in pazienti con ulcera viene definita dalla presenza di: un osso esposto visibile, un osso palpabile con una sonda smussa, dito rosso, gonfio e con ulcerazione, un’ulcera profonda persistente su una prominenza ossea e la presenza di una cavità dei tessuti molli con secrezione purulenta (Niazi et al. 2019).
Trattamento chirurgico
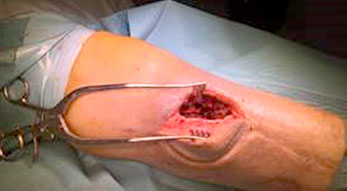
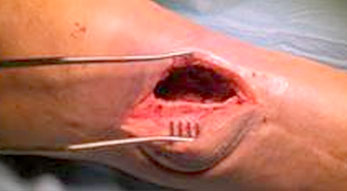
Il trattamento chirurgico dell’osteomielite del piede diabetico prevede un debridement dei tessuti osseo e molle per controllare la fonte dell’infezione con vari campionamenti di tessuto per le analisi microbiologiche. Tutto il tessuto non vitale e necrotico deve essere rimosso e la gestione dello spazio creatosi nell’osso dopo il debridement viene effettuata mediante l’utilizzo di un sostituto osseo sintetico antibiotato (Niazi et al. 2019).
La tecnica Silo (Drampalos et al. 2018) viene utilizzata per le patologie del piede posteriore, soprattutto osteomieliti di calcagno e consiste nel praticare una serie di 4 o 5 fori nel sito dell’infezione -dopo il debridement- effettuare un lavaggio con perossido di idrogeno e uno con soluzione fisiologica e riempire i fori con il carrier antibiotato prescelto.
La ferita chirurgica deve essere sempre richiusa quando possibile, altrimenti viene utilizzata la VAC -vacuum assisted closure- (Niazi et al. 2019). La terapia antibiotica sistemica viene valutata sulla base della sensibilità/resistenza del germe e in base alla risposta del paziente (Niazi et al. 2019).
L’utilizzo di sostituti ossei sintetici antibiotabili riassorbibili e osteoconduttori aiutano ad arrivare ad un tasso di guarigione del 90% in ulcerazioni del piede diabetico con osteomielite conseguente (Niazi et al. 2019).
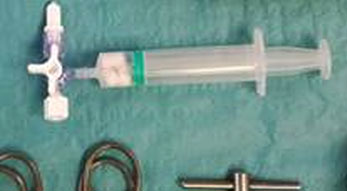
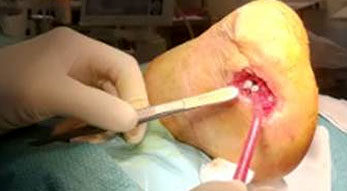
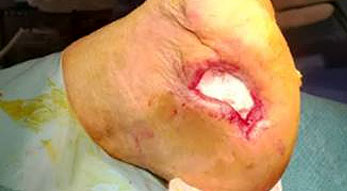
Osteomielite associata a osteosintesi in ossa lunghe
Il rischio di osteomielite associata all’osteosintesi dipende da fattori di rischio paziente-specifici, dal distretto coinvolto e dall’estensione del trauma. Uno dei principali fattori di rischio correlati al paziente è il fumo (Zimmerli & Sendi 2017). La sintesi di una frattura esposta di tibia di grado IIIB Gustilo-Anderson presenta un rischio di infezione pari al 10-15 %, rispetto alla sintesi di una frattura non esposta che raramente incorre in un’infezione (Zimmerli & Sendi 2017). L’osteomielite associata a osteosintesi può essere classificata in base alla patogenesi in: infezione perioperatoria, esogena ed ematogena (Zimmerli & Sendi 2017).
Romanò et al. (2011) propongono una classificazione anatomico-patologica basata sulla stabilità dell’osteosintesi: il tipo I è un’osteosintesi stabile con progressione del callo; tipo II è un’osteosintesi stabile con scarsa o assente progressione del callo; tipo III è un’osteosintesi instabile senza formazione di callo.
Esiste anche una classificazione dell’osteomielite in seguito a frattura esposta che valuta l’intervallo di tempo tra la sintesi e l’insorgenza dei sintomi: infezione precoce, entro le due settimane dall’impianto; infezione ritardata, dalle 3 alle 10 settimane dopo l’impianto; infezione tardiva, dopo le 10 settimane dopo l’impianto. L’infezione tardiva può essere un’infezione acuta ematogena o cronica (Zimmerli & Sendi 2017).
Trattamento chirurgico
La decisione di rimuovere la sintesi interna e sostituirla con una fissazione esterna o lasciarla in sede deve essere presa interdisciplinarmente.
Prima del trattamento chirurgico dell’infezione bisogna stabilizzare la frattura e i frammenti ossei, poiché frammenti ossei instabili facilitano la persistenza di microorganismi e aumentano la probabilità di infezione: devono essere rimossi tutti i sequestri ossei ed essere preservati il più possibile i tessuti molli (Zimmerli & Sendi 2017).
Per stabilire se è possibile mantenere la sintesi interna è fondamentale valutare l’intervallo di tempo trascorso dalla data di impianto e la comparsa della sintomatologia dell’infezione. L’osteosintesi interna può essere mantenuta unicamente in infezioni precoci (Zimmeli & Sendi 2017). Se i mezzi di sintesi non vengono rimossi deve essere disponibile un’ottima terapia antimicrobica; questo non è possibile in infezioni causate da funghi o bacilli Gram-negativi multi-resistenti (Zimmerli & Sendi 2017).
Il trattamento chirurgico deve avere come obiettivo primario il miglior risultato funzionale possibile. Più l’infezione è tardiva e più decrescono le possibilità di guarigione della frattura a causa della persistenza ed espansione del biofilm che soffoca gli osteoblasti e causa sequestri (Zimmerli & Sendi 2017).
Se l’osteosintesi dovesse essere mantenuta, dopo la stabilizzazione ossea e la guarigione della frattura, i mezzi di sintesi dovrebbero essere comunque rimossi e tutte le parti ossee a contatto dovranno essere trattate: è necessario fresare il canale endomidollare nel caso di chiodi, rimuovere la superficie corticale nel caso di placche, trattare i fori delle viti con micro-drilling ed eliminare eventuali tessuti ossei e molli morti. La terapia antimicrobica sistemica può essere di breve durata (Zimmerli & Sendi 2017).
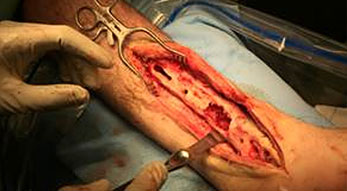
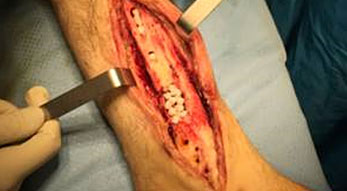
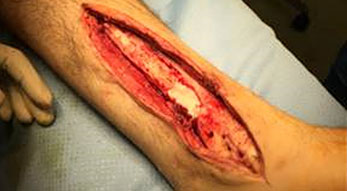
Spondilodiscite
La spondilodiscite è un’osteomielite vertebrale che coinvolge sia le vertebre sia i dischi intervertebrali. Le spondilodisciti spontanee sono circa il 3-5% di tutti i casi di osteomielite ma questa percentuale è in aumento (Waheed et al. 2019). La spondilodiscite si origina nel disco e poi si diffonde alla placca vertebrale terminale e ai tessuti paravertebrali.
Possono essere classificate in: piogeniche, granulomatose e causate da parassiti o funghi (Waheed et al. 2019). L’origine dell’infezione invece può essere triplice: ematogena, causata da siti concomitanti o contigui e per inoculazione esterna. La tubercolosi è la causa primaria di spondilodiscite, seguita da agenti piogenici, mentre infezioni fungine o causate da parassiti restano molto rare (Waheed et al. 2019).
Le spondilodisciti più comuni sono quelle di origine ematogena causate da Staphylococcus, che colpisce principalmente le vertebre lombari, mentre la tubercolosi colpisce principalmente le vertebre toraciche. Le spondilodisciti causate da diffusione contigua sono spesso considerate infezioni polimicrobiche (Waheed et al. 2019).
La spondilodiscite presenta notevoli problemi di diagnosi precoce poiché i dati clinici, nelle fasi iniziali, sono sovrapponibili a quelli di altre malattie della colonna vertebrale (Waheed et al. 2019; Stangenberg et al. 2020).
Trattamento chirurgico
Il successo del trattamento delle spondilodisciti non specifiche e specifiche è basato sul debridement chirurgico e sull’immobilizzazione o fissazione della parte vertebrale infetta, con terapia antibiotica sistemica complementare (Fleege et al. 2020). Lo scopo del trattamento antibiotico è supportare la completa guarigione dell’infezione per prevenire lo sviluppo di un’infezione ricorrente ed evitare la diffusione ematogena. A questo proposito è necessario l’utilizzo intraoperatorio di carrier antibiotabili per il rilascio in loco di elevate concentrazioni di antibiotico (Fleege et al. 2020). Possono essere utilizzate varie tipologie di carrier: polimetilacrilato (PMMA), calcio solfato, calcio solfato e idrossiapatite. A causa della bassa stabilità meccanica e della rapidità con cui viene dissolto, il calcio solfato è utilizzabile limitatamente come carrier per il rilascio di antibiotico (Fleege et al. 2020). L’evoluzione è rappresentata da pellets già formati di idrossiapatite nanocristallina e calcio solfato (PerOssal®), che hanno il vantaggio di eluire l’antibiotico in maniera efficace mantenendo inalterate le proprietà osteoconduttive dei nanocristalli di idrossiapatite (Fleege et al. 2020).
Durante il trattamento chirurgico vengono sempre eseguiti uno sbrigliamento profondo dei tessuti infetti con rimozione di eventuali ascessi e diverse raccolte di campioni per test microbiologici e istologici. Successivamente possono essere posizionate le cage negli spazi intradiscali, mentre gli spazi discali rimanenti vengono riempiti con il carrier antibiotato, in questo caso PerOssal® (Fleege et al. 2020).
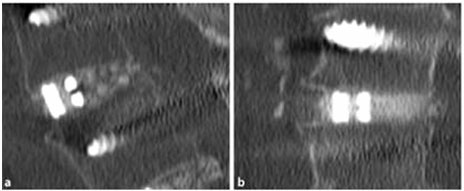
INFEZIONI ARTICOLARI PERI-PROTESICHE E CARRIER ANTIBIOTABILI
Le infezioni peri-protesiche riguardano l’1-2% dei primi impianti e circa il 4% delle revisioni protesiche (Izakovicova et al. 2019). Si ipotizza che la maggior parte delle infezioni precoci si verifichi durante l’impianto e siano attribuite a flora cutanea endogena o a fonti esogene provenienti dalla sala operatoria (Kapadia et al. 2016). Le infezioni possono avvenire attraverso vari meccanismi: semina diretta da contaminanti esterni o diffusione contigua, diffusione ematogena da altri siti del corpo e infezione ricorrente. La suscettibilità alle infezioni aumenta in presenza di impianti e potrebbe provocare la formazione di biofilm (Kapadia et al. 2016).
Le infezioni post impianto vengono normalmente classificate in: precoci, si manifestano a meno di 3 mesi dall’impianto; ritardate, tra i 3 e i 24 mesi dopo l’impianto; tardive, a più di 2 anni dall’impianto (Zimmerli & Sendi 2017). Infezioni ematogene acute o infezioni post-operatorie precoci possono essere trattate con successo con la conservazione dell’impianto, al contrario, la possibilità di eliminare il biofilm da un impianto in un’infezione peri-protesica cronica è minore del 50% anche con una terapia antibiotica prolungata (Zimmerli & Sendi 2017).
Trattamento chirurgico
La cura di un’infezione peri-protesica può essere definita come l’eliminazione di tutti i microrganismi e la conservazione o il ripristino di una buona funzionalità articolare (Zimmerli & Sendi 2017). Il successo del trattamento chirurgico è stato definito come l’eradicazione dell’infezione con una ferita completamente guarita, la mancanza di recidiva, nessun successivo intervento chirurgico per l’infezione dopo il reimpianto e nessun evento di mortalità correlata all’infezione peri-protesica fino a 2 anni dopo l’intervento chirurgico definitivo (Zimmerli & Sendi 2017).
Nonostante le linee guida ben definite della Infectious Disease Society of America, non esiste ancora un consenso universale sulla gestione chirurgica ottimale dell’infezione peri-protesica (Zimmerli & Sendi 2017; Gramlich et al. 2019).
Solitamente i trattamenti chirurgici che prevedono DAIR -debridement, antibiotico sistemico, sostituzione delle parti mobili e ritenzione dell’impianto- vengono utilizzati con successo solamente nelle infezioni precoci, date le buone condizioni di salute del paziente e la virulenza del germe ancora contenuta, in quelle tardive e croniche è preferibile una revisione two-step (Kapadia et al. 2016; Gramlich et al. 2019). La scelta dipende dalla conoscenza della sensibilità del germe ad un particolare antibiotico, dal tempo di diagnosi dell’infezione, dalle condizioni di salute del paziente e dalle valutazioni del chirurgo stesso (Gramlich et al. 2019).
Secondo Maczak et al. (2016), nel caso di una procedura di revisione two-step di protesi totale di ginocchio, riempire il canale endomidollare di tibia e femore con un sostituto osseo sintetico antibiotato riduce sensibilmente la ricomparsa dell’infezione dopo il reimpianto in seguito a revisione della protesi totale di ginocchio. Anche secondo Sakellariou et al. (2015) la combinazione di un sostituto osseo sintetico antibiotato (in questo caso PerOssal®) con uno spaziatore antibiotato aumenta la capacità di eradicazione dell’infezione e minimizza gli svantaggi legati al cemento come il rischio che l’infezione si cronicizzi utilizzando lo spaziatore come substrato per lo sviluppo di biofilm.
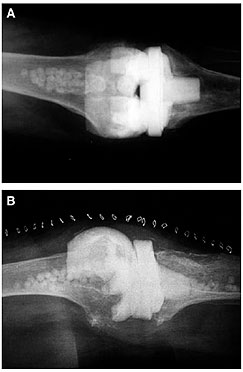
CARRIER ANTIBIOTABILI A BASE DI IDROSSIAPATITE NANOCRISTALLINA E CALCIO SOLFATO
Il principale vantaggio dell’utilizzo di carrier antibiotati è la capacità di eluizione di elevate concentrazioni di antibiotico a livello locale, evitando la tossicità sistemica (Romanò et al. 2014; Ferguson et al. 2017; Visani et al. 2018). Un carrier eluisce una concentrazione di antibiotico dalle 10 alle 100 volte superiore rispetto alla minima concentrazione inibente (MIC) degli organismi presenti e decisamente al di sopra della concentrazione media di eradicazione del biofilm (Ferguson et al. 2017).
Altri vantaggi dell’uso in loco di carrier antibiotati sono la loro capacità di venire rimodellati, avendo potere osteoconduttivo e il sostegno meccanico all’interno della cavità, che minimizza di rischio di fratture peri-cavitarie (Ferguson et al. 2017).
Tra i vari carrier presenti sul mercato, l’unico sostituto osseo sintetico non precaricato con uno specifico antibiotico e avente una composizione a base di calcio solfato e di idrossiapatite è PerOssal® (Ferguson et al. 2017). L’utilizzo di solo calcio solfato nel riempimento delle cavità ossee risultanti dopo debridement chirurgico è stato associato ad una percentuale di frattura dell’osso del 5-14% e a una non adeguata riparazione dell’osso. Al contrario, il tasso di frattura si minimizza al 3% utilizzando carrier di idrossiapatite e calcio solfato. Questo si riflette anche nel rilascio di siero dalla ferita e nella tempistica di guarigione (Ferguson et al. 2017).
Il calcio solfato è in grado di rilasciare un’elevata concentrazione di antibiotico poiché si degrada molto rapidamente, ma non è in grado di fornire sostegno meccanico e non è un valido scaffold per la rigenerazione ossea nel lungo periodo a causa dell’elevata velocità di degradazione e della minima porosità del materiale (Ferguson et al. 2017; Harris et al. 2018). Al contrario, l’idrossiapatite è il materiale più osteoconduttivo tra calcio solfato, calcio fosfato di vario genere e ortofosfati ceramizzati, grazie alla sua struttura chimica, molto simile all’apatite ossea naturale (Nilsson et al. 2013). I carrier composti da calcio solfato e idrossiapatite nanocristallina porosa hanno un ottimo potenziale di riparazione ossea nel tempo rispetto a quelli di solo calcio solfato, che si degradano troppo rapidamente (Nilsson et al. 2013; Ferguson et al. 2017).
I cementi al contrario, oltre a non permettere la crescita di nuovo tessuto osseo a causa della dimensione eccessivamente ridotta dei pori, eluiscono una concentrazione inferiore di antibiotico e devono essere rimossi una volta terminata l’eluizione (Ferguson et al. 2017).
Secondo Ferguson et al. (2017) l’innesto ideale, per fornire la corretta eluizione di antibiotico ad elevata concentrazione, il giusto sostegno meccanico e una buona osteoconduzione, deve essere formato da idrossiapatite e calcio solfato.

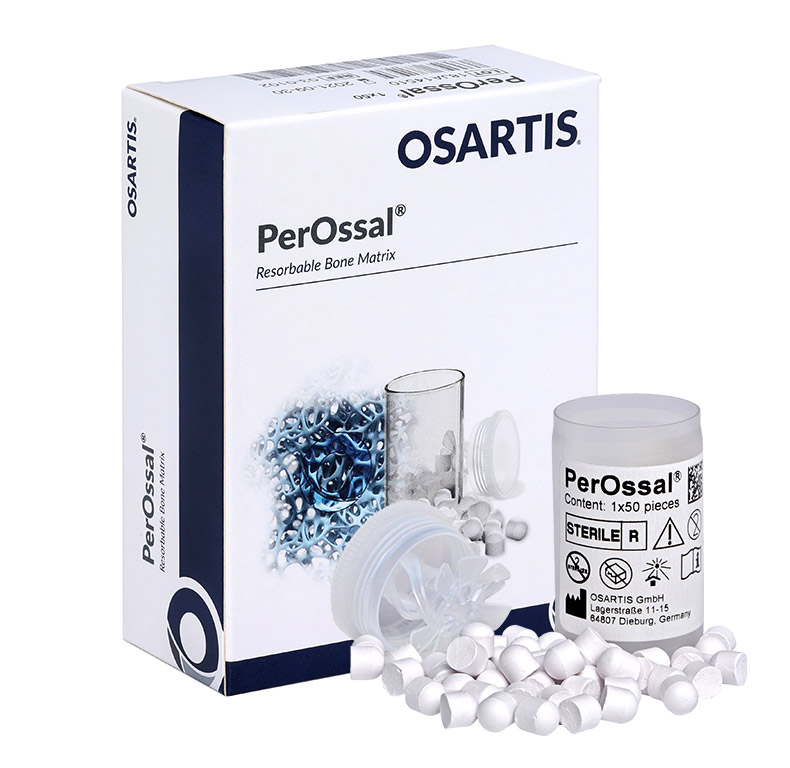
PerOssal® è un sostituto osseo sintetico addizionabile a soluzioni antibiotate e formulato per il trattamento di infezioni ossee cavitarie. PerOssal® è composto dal 51.5% di idrossiapatite nanocristallina e dal 48.5% di calcio solfato.
È disponibile in confezione sterile già formato in pellets da 6 mm di diametro, aventi un’estremità sferica e una piana, proprio per favorire sia l’eluizione di antibiotico sia la capacità osteoconduttiva dell’idrossiapatite nanocristallina.
La presenza di idrossiapatite nanocristallina permette di coniugare un’ottima capacità di eluizione dell’antibiotico con cui si caricano i pellets e un’ottima osteoconduzione. Una volta terminata l’eluizione il calcio solfato viene degradato rapidamente mentre l’idrossiapatite rimane in loco e viene rimodellata più lentamente, mantenendo stabile la cavità.
PerOssal® può essere associato a 4 differenti antibiotici: Vancomicina, Rifampicina, Gentamicina e Tobramicina; ha pertanto un ampio spettro di copertura antimicrobica.


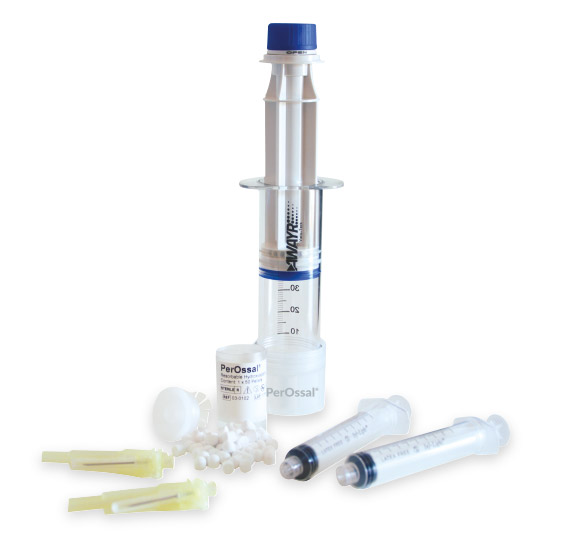
PerInfections è l’unico assemblato destinato al trattamento delle infezioni ossee cavitarie, che unisce l’efficienza della perfusione, per l’associazione di soluzioni antibiotate, con il sostituto osseo sintetico PerOssal®.
L’aria intrappolata nei pori più profondi del biomateriale poroso PerOssal® può compromettere significativamente il corretto caricamento con antibiotici, perciò si è pensato di utilizzare il perfusore AWAYR® che, in condizioni di vuoto, è in grado di espellere l’aria dai pori del biomateriale sostituendola con la soluzione antibiotata prescelta, garantendo la saturazione completa del biomateriale.
Le perle di PerOssal® perfuse, una volta inserite nella cavita ossea infetta, eluiscono l’antibiotico in loco per circa 10 giorni sopra il MIC (concentrazione minima inibente) permettendo l’eradicazione dell’infezione. Una volta terminata l’eluizione l’idrossiapatite nanocristallina permette il sostegno strutturale della cavità e un effetto osteoconduttivo del biomateriale, favorendo la formazione di nuovo tessuto osseo.
Qualora le perle di PerOssal® fossero in contatto con tessuti molli è indicato l’uso della membrana in collagene SURGICOLL® a funzione di neo-periostio, per proteggere la ferita o i tessuti circostanti da possibili irritazioni da biomateriale.
LA PERFUZIONE CON AWAYR®
La perfusione è un nuovo concetto di associazione di un liquido ad un biomateriale poroso con l’ausilio di una pressione negativa. La perfusione infatti estraendo le bolle d’aria dalle porosità più profonde permette la saturazione del biomateriale con il liquido prescelto grazie alla sua risalita nelle porosità liberate dalle bolle d’aria. L’utilizzo di un vacuum all’interno del device per la perfusione è fondamentale in quanto è proprio questa pressione negativa che permette di eliminare le bolle d’aria presenti nelle trabecole del biomateriale e al fluido di saturarle completamente, mantenendo inalterate le caratteristiche chimico-fisiche e biologiche di entrambi.
La perfusione è un metodo rapido, efficace e sicuro per saturare un biomateriale poroso con un liquido o una soluzione.
L’imbibizione di un materiale non è altrettanto efficiente in quanto un materiale imbibito viene lasciato immerso nel liquido per un certo tempo e poi utilizzato, ma a causa della presenza di bolle di aria nelle trabecole del biomateriale, la capillarità del liquido non è sufficiente per saturare il biomateriale. La sezione di un materiale imbibito evidenzia che il liquido è in grado di penetrare solo i primi strati superficiali del biomateriale, lasciando il centro completamente asciutto; al contrario, la sezione di un materiale perfuso mostra come il liquido abbia saturato il biomateriale fino al centro.
La sostanziale differenza tra imbibizione e perfusione si nota soprattutto nella successiva capacità di rimodellamento e/o cessione del biomateriale, in questo caso di eluizione dell’antibiotico prescelto con cui sono stati perfusi i pellets di PerOssal®.
Con il kit PerInfections, grazie alla perfusione con AWAYR®, si massimizza l’up-take dell’antibiotico in fase di caricamento dei pellets di PerOssal® con un procedimento in completa sicurezza: il biomateriale viene perfuso in un ambiente chiuso, sterile, pulito, dove rimane fino al momento dell’impianto.
AWAYR®, apparentemente una semplice siringa, è dotata di uno speciale filtro labirintico brevettato, costituito da minuscoli canali del diametro di pochi micron, che permette la fuoriuscita dell’aria ma non del liquido di perfusione. AWAYR® può essere impostato in due stati, chiuso -per la perfusione- o aperto. Nello stato chiuso, il sistema è sigillato ermeticamente e il movimento di aspirazione dello stantuffo realizza una forte depressione che permette l’estrazione dell’aria dall’innesto e l’ingresso nello stesso della soluzione desiderata, mantenendo inalterate le proprietà sia del fluido sia dell’innesto; nello stato aperto l’aria defluisce attraverso il filtro labirintico al di fuori della siringa senza poter ritornare all’interno dell’innesto.
RISULTATI
PerOssal® è stato utilizzato con successo nel trattamento di osteomieliti croniche, spondilodisciti e nel trattamento two-step delle infezioni peri-protesiche, come attestano vari studi (Rauschmann et al. 2005; Stechow & Rauschmann 2009; Romanò et al. 2014; Vugt et al. 2016; Visani et al. 2018; Fleege et al 2020). Le caratteristiche chimico-fisiche di PerOssal® hanno infatti permesso l’eradicazione dell’infezione, nessuna recidiva e un’ottima gestione dello spazio cavitario risultante dopo il debridement.
Romanò et al. (2014) riportano che ad una media di 22 mesi il 90% dei pazienti trattati con PerOssal® per osteomielite cronica non mostra segni di infezione ricorrente e la guarigione della ferita risulta essere molto buona.
La III Clinica diretta dal Prof. Donati dell’Istituto Ortopedico Rizzoli di Bologna riporta degli ottimi risultati sia nella capacità di PerOssal® di eliminare l’infezione, sia nell’ottimizzazione del processo di preparazione del materiale grazie al kit PERINFECTIONS, che migliora le qualità di PerOssal®. Inoltre, l’utilizzo di un feltro in collagene o Spongostan® a chiusura della cavità dopo il riempimento con PerOssal®, funge da neo-periostio, proteggendo i tessuti molli, prevenendo la formazione di siero e permettendo una rapida guarigione della ferita chirurgica. In questo modo si minimizzano i rischi sia di una recidiva dell’infezione, dovuta al tramite della ferita, sia la deiscenza della ferita stessa e si facilita la chiusura dei dotti fistolosi, se presenti. Gli specialisti del Team del Prof. Donati infatti, attestano che mediante questa procedura non è stata osservata produzione di siero dalla ferita, deiscenza della ferita e recidiva dell’infezione.
L’idrossiapatite nanocristallina permette la corretta gestione della cavità dell’osteomielite dopo il debridement, fornendo sostegno meccanico nel breve periodo e garantendone il rimodellamento e la sostituzione con tessuto osseo naturale del paziente nel medio-lungo periodo.
Vugt et al. (2016) con la loro review attestano che i risultati ottenuti per il trattamento delle osteomieliti con carrier antibiotati a rilascio locale controllato sono pari all’80-100% nell’eradicazione dell’infezione, con un tasso di crescita ossea pari all’87,5-100% e la degradazione del carrier è pari al 100%, dopo il tempo necessario stimato in base al materiale.
Lo studio di Visani et al. (2018) dimostra come la percentuale di guarigione dei pazienti trattati con PerOssal® fosse pari al 86,5% e statisticamente significativamente più alta rispetto a quella di pazienti trattati con altri biomateriali che si fermava al 50%. La composizione di questo biomateriale permette infatti di riempire la cavità risultante dopo un aggressivo debridement, eluire alte concentrazioni di antibiotico in loco e di fungere da scaffold per la formazione di nuovo tessuto osseo, ripristinando le proprietà meccaniche e fisiologiche dell’osso dopo il trattamento chirurgico e minimizzando le reazioni infiammatorie riscontrate con l’uso di biomateriali composti solo da calcio solfato.
Lo studio di Fleege et al. (2020) dimostra come l’utilizzo di PerOssal® per il rilascio locale di antibiotico nelle spondilodisciti riesca a ridurre il tempo della terapia antibiotica sistemica a 10 giorni e a 15 giorni quella orale. Questo permette di diminuire gli effetti collaterali e l’incompatibilità della terapia antibiotica con simili risultati di guarigione. Inoltre, minimizza lo sviluppo di resistenze.
Nello studio di von Stechow & Rauschmann (2009) 12 pazienti trattati con PerOssal®, seguiti per almeno 1 anno, hanno mostrato una normalizzazione dei parametri di infezione, nessuna perdita ossea nelle regioni
interessate e una fusione ossea a 3-6 mesi dopo l’intervento. Nessun intervento di revisione è stato correlato all’uso di PerOssal®. Al follow-up non è stato riscontrato nessun segno di un’infezione in corso.
L’utilizzo di sostituti ossei sintetici antibiotati nella cura dell’osteomielite del piede diabetico ha determinato l’eradicazione dell’infezione con successo nel 90% dei casi, con guarigione dell’ulcerazione pari al 81% dei casi. Tutti i pazienti sono stati seguiti fino all’eradicazione completa dell’infezione, guarigione della ferita e dell’ulcera se presente (Niazi et al. 2019). Un fallimento più elevato nel piede posteriore rispetto alle altre zone trattate è dovuto all’inadeguata copertura dei tessuti molli (Niazi et al. 2019).
Anche secondo Drampalos et al. (2018) l’utilizzo di carrier antibiotabili a base di calcio solfato e idrossiapatite e l’applicazione della tecnica Silo ha portato all’eradicazione dell’infezione in tutti i pazienti trattati.
Gramlich et al. (2019) evidenziano come, anche nel trattamento delle infezioni peri-protesiche, l’utilizzo di sostituti ossei sintetici antibiotabili dopo aver eseguito il DAIR permetta di eradicare efficacemente l’infezione nel 78% dei casi e di mantenere l’impianto nel 85%.
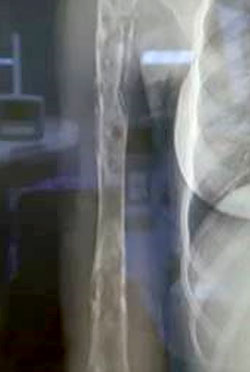

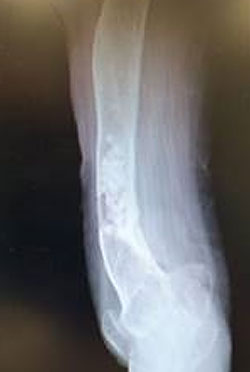
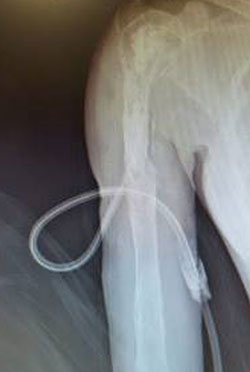
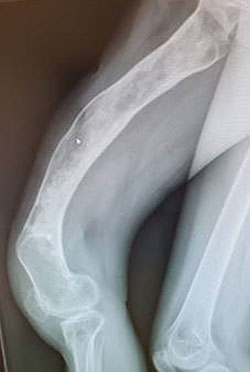
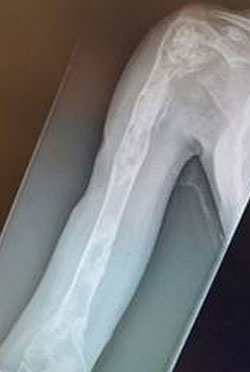
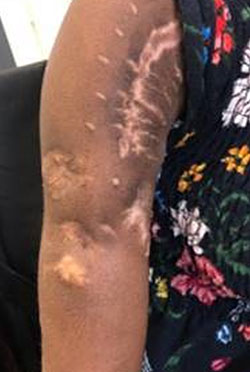
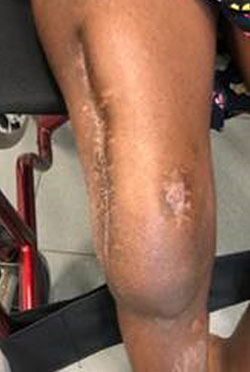
Debridment VS debridment + carrier antibiotabile
Visani et al. (2018) nel loro studio asseriscono come il debridement chirurgico con aggiunta di un sostituto osseo sintetico antibiotato aumenti il tasso di guarigione se comparato al solo debridement chirurgico.
Anche secondo Gramlich et al. (2019) l’utilizzo di sostituti ossei sintetici antibiotabili in aggiunta alla procedura chirurgica DAIR aumentano la percentuale di successo nell’eradicazione dell’infezione e nella possibilità di ritenzione dell’impianto.
CONCLUSIONI
La completa eradicazione dell’infezione resta una sfida a causa della limitata capacità degli antibiotici di penetrare il tessuto osseo infetto, poco vascolarizzato o necrotico, e i tessuti molli circostanti (Romanò et al. 2014; Niazi et al. 2019). Spesso si rende necessario un intervento chirurgico di rimozione dei tessuti e degli impianti infetti (Romanò et al. 2014).
Le infezioni ossee, con particolare riferimento alle osteomieliti croniche, sono un’importante causa di morbilità e spesso richiedono molteplici interventi chirurgici e un’equipe medica interdisciplinare (Visani et al. 2018). Infatti, le infezioni ossee, specialmente in presenza di necrosi, possono essere persistenti a causa della formazione del biofilm (Niazi et al. 2019). Il biofilm è associato a un metabolismo più lento e a un minor tasso di replicazione batterica con una conseguente minor efficacia degli agenti antimicrobici (Niazi et al. 2019). Sistemi di rilascio di antibiotici a livello locale, come PerOssal®, posizionati nella cavità ossea risultante dopo il debridement, forniscono elevate concentrazioni di antibiotico senza incorrere in eventi di tossicità sistemica, permettendo di eradicare il biofilm e tutti i microorganismi residui rimasti in forma planctonica dopo il debridement (Romanò et al. 2014; Niazi et al. 2019).
L’utilizzo di sostituti ossei sintetici antibiotabili riassorbibili e soprattutto osteoconduttori, grazie alla presenza di idrossiapatite, aiuta a raggiungere un tasso di guarigione del 90% in ulcerazioni del piede diabetico con osteomielite conseguente, riducendo il rischio di amputazione grazie alla preservazione dell’osso e al mantenimento della funzionalità del piede (Niazi et al. 2019).
Il sostituto osseo sintetico antibiotabile PerOssal® è un prodotto estremamente sicuro ed efficace nel trattamento dell’osteomielite cronica delle ossa lunghe, dell’osteomielite del piede diabetico, di spondilodisciti e di infezioni peri-protesiche, soprattutto grazie alla sua composizione e struttura (Romanò et al. 2014; Sakellariou et al. 2015; Visani et al. 2018; Fleege et al. 2020). Inoltre, PerOssal® presenta eccellenti proprietà in termini di riassorbimento, biocompatibilità e rilascio di antibiotici (Rauschmann et al. 2005). Il kit PerInfections permette di massimizzare e ottimizzare le proprietà di PerOssal®, migliorando la rapidità di associazione con l’antibiotico prescelto, la velocità di preparazione e garantendo un ambiente di preparazione completamente sicuro.
Redazione scientifica: Dott.ssa Carlotta Boschian, Dott.ssa Giulia Dinelli
BIBLIOGRAFIA
- Dym, H., & Zeidan, J. (2017). Microbiology of acute and chronic osteomyelitis and antibiotic treatment. Dental Clinics, 61(2), 271-282.
- Rauschmann, M. A., Wichelhaus, T. A., Stirnal, V., Dingeldein, E., Zichner, L., Schnettler, R., & Alt, V. (2005). Nanocrystalline hydroxyapatite and calcium sulphate as biodegradable composite carrier material for local delivery of antibiotics in bone infections. Biomaterials, 26(15), 2677-2684.
- von Stechow, D., & Rauschmann, M. A. (2009). Effectiveness of combination use of antibiotic-loaded PerOssal® with spinal surgery in patients with spondylodiscitis. European Surgical Research, 43(3), 298-305.
- Drampalos, E., Mohammad, H. R., Kosmidis, C., Balal, M., Wong, J., & Pillai, A. (2018). Single stage treatment of diabetic calcaneal osteomyelitis with an absorbable gentamicin-loaded calcium sulphate/hydroxyapatite biocomposite: the Silo technique. The Foot, 34, 40-44.
- McNally, M. A., Ferguson, J. Y., Lau, A. C. K., Diefenbeck, M., Scarborough, M., Ramsden, A. J., & Atkins, B. L. (2016). Single-stage treatment of chronic osteomyelitis with a new absorbable, gentamicin-loaded, calcium sulphate/hydroxyapatite biocomposite: a prospective series of 100 cases. The Bone & Joint Journal, 98(9), 1289-1296.
- Harris, M., Ahmed, H., Pace, L., Minter, J., Neel, M., & Jennings, J. (2018). Evaluation of Antibiotic-Releasing Triphasic Bone Void Filler In-Vitro. Journal of functional biomaterials, 9(4), 55.
- Visani, J., Staals, E. L., & Donati, D. (2018). Treatment of chronic osteomyelitis with antibiotic-loaded bone void filler systems: an experience with hydroxyapatites calcium-sulfate biomaterials. Acta Orthop Belg, 84, 25-29.
- Lew, D. P., & Waldvogel, F. A. (2004). Osteomyelitis. The Lancet, 364(9431), 369-379.
- Zimmerli, W., & Sendi, P. (2017). Orthopaedic biofilm infections. Apmis, 125(4), 353-364.
- Romanò, C. L., Logoluso, N., Meani, E., Romanò, D., De Vecchi, E., Vassena, C., & Drago, L. (2014). A comparative study of the use of bioactive glass S53P4 and antibiotic-loaded calcium-based bone substitutes in the treatment of chronic osteomyelitis: a retrospective comparative study. The bone & joint journal, 96(6), 845-850.
- Van Vugt, T. A. G., Geurts, J., & Arts, J. J. (2016). Clinical application of antimicrobial bone graft substitute in osteomyelitis treatment: a systematic review of different bone graft substitutes available in clinical treatment of osteomyelitis. BioMed research international, 2016.
- Fleege, C., Rauschmann, M., Arabmotlagh, M., & Rickert, M. (2020). Development and current use of local antibiotic carriers in spondylodiscitis: pilot study on reduction of duration of systemic treatment. Der Orthopäde, 1-10.
- Stangenberg, M., Mohme, M., Mende, K. C., Thiesen, D. M., Krätzig, T., Schoof, B., … & Dreimann, M. (2020). Impact of the localization on disease course and clinical management in spondylodiscitis. International Journal of Infectious Diseases.
- Waheed, G., Soliman, M. A., Ali, A. M., & Aly, M. H. (2019). Spontaneous spondylodiscitis: review, incidence, management, and clinical outcome in 44 patients. Neurosurgical Focus, 46(1), E10.
- Izakovicova, P., Borens, O., & Trampuz, A. (2019). Periprosthetic joint infection: current concepts and outlook. EFORT open reviews, 4(7), 482-494.
- Kapadia, B. H., Berg, R. A., Daley, J. A., Fritz, J., Bhave, A., & Mont, M. A. (2016). Periprosthetic joint infection. The Lancet, 387(10016), 386-394.
- Gramlich, Y., Walter, G., Klug, A., Harbering, J., Kemmerer, M., & Hoffmann, R. (2019). Procedure for single-stage implant retention for chronic periprosthetic infection using topical degradable calcium-based antibiotics. International Orthopaedics, 43(7), 1559-1566.
- Niazi, N. S., Drampalos, E., Morrissey, N., Jahangir, N., Wee, A., & Pillai, A. (2019). Adjuvant antibiotic loaded bio composite in the management of diabetic foot osteomyelitis—a multicentre study. The Foot, 39, 22-27.
- Sakellariou, V. I., Savvidou, O., Markopoulos, C., Drakou, A., Mavrogenis, A. F., & Papagelopoulos, P. J. (2015). Combination of calcium hydroxyapatite antibiotic Carrier with cement spacers in peri-prosthetic knee infections. Surgical Infections, 16(6), 748-754.
- Iannotti, J. P., & Parker, R. (2013). The Netter Collection of Medical Illustrations: Musculoskeletal System, Volume 6, Part III-Musculoskeletal Biology and Systematic Musculoskeletal Disease E-Book. Elsevier Health Sciences