Numero 6 di Lettere di Ortobiologia
IL COLLAGENE IDROLIZZATO: LA BUSSOLA PER L’OSTEOARTROSI
PREFAZIONE
La ricerca bibliografica effettuata per la redazione di questo testo ha evidenziato come la predominanza degli studi riguardi il collagene idrolizzato assunto per via orale, sia su animale che su umano, mentre i vari studi in vitro siano stati condotti su condrociti coltivati con medium a base di collagene idrolizzato.
Le iniezioni intra-articolari o periarticolari di collagene idrolizzato costituiscono una nuova frontiera nel trattamento di patologie degenerative quali osteoartrosi e tendinopatie, a supporto delle quali non ci sono ancora numerosi lavori.
LA CARTILAGINE ARTICOLARE

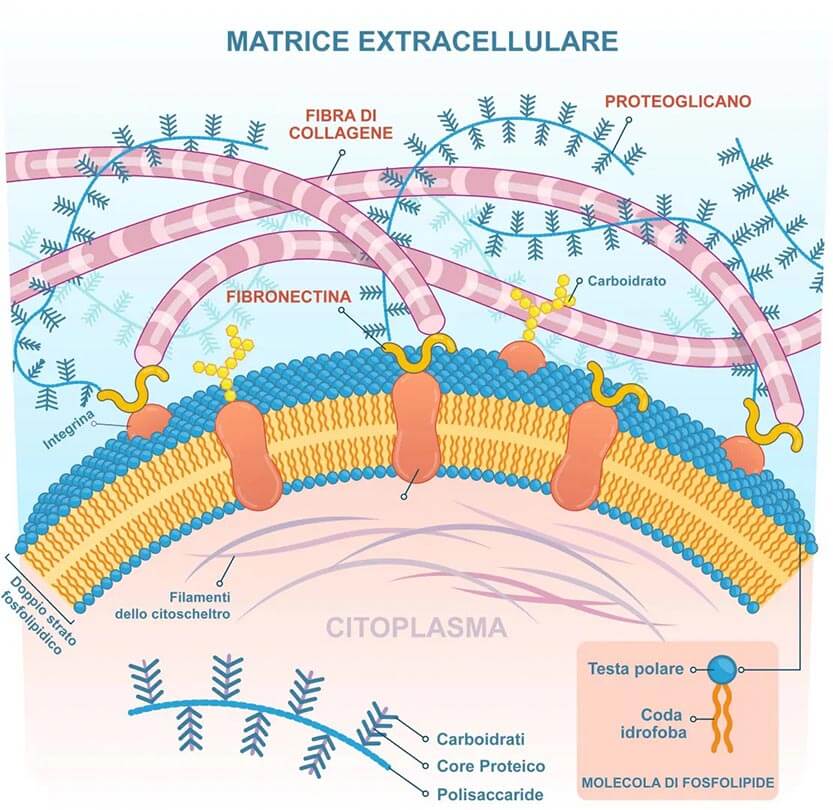
La cartilagine articolare ialina è un tessuto avascolare e aneurale di 2-4mm di spessore, costituito da una matrice extracellulare in cui sono immersi i condrociti. La matrice extracellulare è composta principalmente da collagene e proteoglicani, soprattutto aggrecano e glicosaminoglicani, come l’acido ialuronico; i condrociti costituiscono solo l’1-2% del volume cartilagineo totale (Jiang et al. 2014; Oláh et al. 2020).
La funzione principale della cartilagine ialina è quella di fornire una superficie articolare liscia e lubrificata così da facilitare la trasmissione dei carichi con un basso coefficiente di attrito (Oláh et al. 2020).
La matrice extracellulare contiene principalmente acqua (>70%) e due componenti organiche: il collagene di tipo II e l’aggrecano, che fornisce resistenza alla trazione e resilienza alla compressione (Oláh et al. 2020).
Istologicamente la cartilagine articolare può essere suddivisa in tre zone differenti, superficiale, di transizione e profonda o radiale, in base all’orientamento generale delle fibrille di collagene, alla morfologia e alla disposizione dei condrociti e alle proprietà di colorazione della matrice (Oláh et al. 2020). Nella zona superficiale le fibre di collagene hanno un orientamento parallelo rispetto alla superficie articolare, vi è una scarsa componente cellulare e di proteoglicani e il contenuto idrico è elevato. La zona di transizione è caratterizzata da fibre di collagene di diametro maggiore, disposte ad intreccio apparentemente amorfo, i condrociti presenti hanno forma sferoidale e vi è una maggiore secrezione di matrice extracellulare. Nella zona profonda le fibre di collagene sono disposte perpendicolarmente rispetto alla superficie articolare, è presente un contenuto idrico minore, la quantità di proteoglicani è massima e i condrociti si trovano impilati in colonne di 4-8 unità, perpendicolari alla superficie articolare. Tra la zona profonda e lo strato di cartilagine calcificata si trova una sottile banda più densa, visibile radiologicamente, di 5 µm di cartilagine mineralizzata, chiamata tidemark. Al di sotto del tidemark si trova una zona di transizione di cartilagine calcificata che riduce lo “stress riser” tra l’osso, molto più rigido, e la cartilagine. Nella zona di cartilagine calcificata, solitamente molto sottile, i condrociti sono rari, di grandi dimensioni e secernono matrice extracellulare simil-ossea. La sua funzione fisiologica è formare un’interfaccia cartilagine/osso per limitare la trasmissione delle forze dall’osso agli strati più profondi della cartilagine (Kon et al. 2012; Oláh et al. 2020). Ancora al di sotto troviamo l’osso subcondrale che fornisce supporto meccanico e metabolico alla cartilagine articolare, assorbe gli urti e mantiene la forma articolare (Oláh et al. 2020).
La formazione e il mantenimento della cartilagine articolare dipendono dall’attività dei condrociti, derivati dal differenziamento delle cellule mesenchimali durante la morfogenesi scheletrica. I condrociti promuovono l’aumento della matrice extracellulare durante l’accrescimento, mentre nel tessuto maturo occupano meno del 10% del volume, provvedendo al continuo rinnovamento molecolare della matrice cartilaginea. I condrociti sono cellule metabolicamente attive che reagiscono a vari stimoli ambientali quali: fattori di crescita, interleuchine, molecole farmacologiche, molecole della matrice, stimoli meccanici e cambiamenti nella pressione idrostatica. In particolare, molecole quali l’interleuchina-2 stimolano i condrociti ad un’attività catabolica, promuovendo la degradazione della matrice extracellulare invece del suo rinnovamento (Kon et al. 2012).
La matrice extracellulare è costituita per l’80% da acqua e per il restante 20% da proteoglicani e collagene. I proteoglicani, in particolare l’aggrecano, il principale nella cartilagine, attirano l’acqua per osmosi grazie alla loro composizione, controllandone l’ingresso (Kon et al. 2012).
Il collagene, il principale costituente della matrice cartilaginea, media alcune importanti proprietà meccaniche della cartilagine, in particolare quelle di tensione e di taglio e immobilizza i proteoglicani all’interno della matrice. Le molecole di collagene interagiscono tra loro tramite legami intra ed inter-molecolari, formando uno stretto intreccio tridimensionale che conferisce proprietà di tensione al tessuto cartilagineo (Kon et al. 2012).
LA CARTILAGINE ARTICOLARE
La cartilagine articolare ialina è un tessuto avascolare e aneurale di 2-4mm di spessore, costituito da una matrice extracellulare in cui sono immersi i condrociti. La matrice extracellulare è composta principalmente da collagene e proteoglicani, soprattutto aggrecano e glicosaminoglicani, come l’acido ialuronico; i condrociti costituiscono solo l’1-2% del volume cartilagineo totale (Jiang et al. 2014; Oláh et al. 2020).
La funzione principale della cartilagine ialina è quella di fornire una superficie articolare liscia e lubrificata così da facilitare la trasmissione dei carichi con un basso coefficiente di attrito (Oláh et al. 2020).

La matrice extracellulare contiene principalmente acqua (>70%) e due componenti organiche: il collagene di tipo II e l’aggrecano, che fornisce resistenza alla trazione e resilienza alla compressione (Oláh et al. 2020).
Istologicamente la cartilagine articolare può essere suddivisa in tre zone differenti, superficiale, di transizione e profonda o radiale, in base all’orientamento generale delle fibrille di collagene, alla morfologia e alla disposizione dei condrociti e alle proprietà di colorazione della matrice (Oláh et al. 2020). Nella zona superficiale le fibre di collagene hanno un orientamento parallelo rispetto alla superficie articolare, vi è una scarsa componente cellulare e di proteoglicani e il contenuto idrico è elevato. La zona di transizione è caratterizzata da fibre di collagene di diametro maggiore, disposte ad intreccio apparentemente amorfo, i condrociti presenti hanno forma sferoidale e vi è una maggiore secrezione di matrice extracellulare. Nella zona profonda le fibre di collagene sono disposte perpendicolarmente rispetto alla superficie articolare, è presente un contenuto idrico minore, la quantità di proteoglicani è massima e i condrociti si trovano impilati in colonne di 4-8 unità, perpendicolari alla superficie articolare. Tra la zona profonda e lo strato di cartilagine calcificata si trova una sottile banda più densa, visibile radiologicamente, di 5 µm di cartilagine mineralizzata, chiamata tidemark. Al di sotto del tidemark si trova una zona di transizione di cartilagine calcificata che riduce lo “stress riser” tra l’osso, molto più rigido, e la cartilagine. Nella zona di cartilagine calcificata, solitamente molto sottile, i condrociti sono rari, di grandi dimensioni e secernono matrice extracellulare simil-ossea. La sua funzione fisiologica è formare un’interfaccia cartilagine/osso per limitare la trasmissione delle forze dall’osso agli strati più profondi della cartilagine (Kon et al. 2012; Oláh et al. 2020). Ancora al di sotto troviamo l’osso subcondrale che fornisce supporto meccanico e metabolico alla cartilagine articolare, assorbe gli urti e mantiene la forma articolare (Oláh et al. 2020).
La formazione e il mantenimento della cartilagine articolare dipendono dall’attività dei condrociti, derivati dal differenziamento delle cellule mesenchimali durante la morfogenesi scheletrica. I condrociti promuovono l’aumento della matrice extracellulare durante l’accrescimento, mentre nel tessuto maturo occupano meno del 10% del volume, provvedendo al continuo rinnovamento molecolare della matrice cartilaginea. I condrociti sono cellule metabolicamente attive che reagiscono a vari stimoli ambientali quali: fattori di crescita, interleuchine, molecole farmacologiche, molecole della matrice, stimoli meccanici e cambiamenti nella pressione idrostatica. In particolare, molecole quali l’interleuchina-2 stimolano i condrociti ad un’attività catabolica, promuovendo la degradazione della matrice extracellulare invece del suo rinnovamento (Kon et al. 2012).
La matrice extracellulare è costituita per l’80% da acqua e per il restante 20% da proteoglicani e collagene. I proteoglicani, in particolare l’aggrecano, il principale nella cartilagine, attirano l’acqua per osmosi grazie alla loro composizione, controllandone l’ingresso (Kon et al. 2012).
Il collagene, il principale costituente della matrice cartilaginea, media alcune importanti proprietà meccaniche della cartilagine, in particolare quelle di tensione e di taglio e immobilizza i proteoglicani all’interno della matrice. Le molecole di collagene interagiscono tra loro tramite legami intra ed inter-molecolari, formando uno stretto intreccio tridimensionale che conferisce proprietà di tensione al tessuto cartilagineo (Kon et al. 2012).
LA DEGENERAZIONE CARTILAGINEA E L’OSTEOARTROSI
L’osteoartrosi (OA) è tra le maggiori cause di disabilità e costituisce il problema più grande per la sanità pubblica nel secolo corrente (Honvo et al. 2020; Weber et al. 2020). Comunemente l’OA coinvolge soprattutto le articolazioni soggette al carico del peso e influisce considerevolmente sulla qualità della vita a causa del dolore cronico e delle limitazioni nella funzionalità articolare (Honvo et al. 2020).
Il processo che porta alla degradazione cartilaginea è costituito da molte variabili e si verifica con modalità e tempistiche estremamente varie. Al contrario, le cause sono riconducibili ad un numero limitato di eventi che attivano meccanismi degradativi i quali, agendo sulle componenti proteiche e glicidiche del tessuto, ne determinano la progressiva idrolisi (Kon et al. 2012).
Solitamente, alle alterazioni anatomiche corrisponde anche una modifica funzionale delle caratteristiche biomeccaniche del tessuto che causa una risposta inadeguata alle sollecitazioni meccaniche (Kon et al. 2012). L’OA e l’artrite reumatoide compromettono sia le caratteristiche strutturali sia quelle funzionali del tessuto cartilagineo (Kon et al. 2012).
Le lesioni del tessuto cartilagineo articolare, oltre che di natura puramente patologica, possono essere conseguenze di un evento traumatico, che poi, a causa della ridotta capacità rigenerativa di questo tessuto, si evolve nella patologia artrosica. Infatti, il naturale processo di riparazione cartilaginea porta alla formazione di tessuto fibrocartilagineo, con capacità meccaniche notevolmente inferiori. Inoltre, il meccanismo “auto-riparativo” viene completato solo nel caso di piccole perdite di sostanza, quelle di maggiori dimensioni, o che coinvolgono l’osso subcondrale, raramente vengono colmate spontaneamente (Kon et al. 2012).
La fisiopatologia della degenerazione articolare (Degenerative Joint Disease – DJD) implica vari fattori quali: l’età avanzata, sindromi metaboliche, mal-allineamenti relativi agli arti inferiori, traumi e infiammazioni sistemiche (Weber et al. 2020).
Il gold standard nella diagnosi dell’OA è la valutazione radiografica, ma è la risonanza magnetica (MRI), in particolare il metodo dGEMRIC (contrasto con gadolinio), che permette di valutare la trasformazione della cartilagine con il progredire della patologia (Weber et al. 2020).
Alcune molecole possono essere utilizzate come biomarker della patologia artrosica e un aumento nelle concentrazioni di biomarker quali interleuchina 6 (IL-6), interleuchina 8 (IL-8), metalloproteasi della matrice (MMPs), proteine della matrice oligomerica della cartilagine (COMP), fattori di necrosi tumorale (TNF) ed altri, presenti nel fluido sinoviale, sono stati associati all’attivazione di cascate molecolari che stimolano la degenerazione della cartilagine e contribuiscono allo sviluppo e al progredire dell’OA (Weber et al. 2020).
Alcuni biomarker specifici possono aiutare a individuare con successo gli individui ad alto rischio di OA, prevederne il decorso, in modo tale da aiutare lo sviluppo di test diagnostici e terapie personalizzate (Weber et al. 2020).
La gran parte dei biomarker analizzati in vari studi riguarda l’articolazione del ginocchio e al loro livello si associa la degenerazione cartilaginea (Weber et al. 2020).
L’OA è il risultato di un’alterazione sia dell’equilibrio metabolico tra cartilagine, membrana sinoviale e osso subcondrale, sia del metabolismo dei condrociti, che assumono funzione catabolica, producendo, insieme alla membrana sinoviale, alcuni mediatori della flogosi come le citochine pro-infiammatorie (Kon et al. 2012). Questi mediatori promuovono la degradazione della matrice extracellulare che, a sua volta, causa l’assottigliamento della cartilagine articolare e conseguentemente, un aumento della densità dell’osso subcondrale, in risposta all’aumentare del carico non più supportato dalla cartilagine progressivamente degenerata (Kon et al. 2012).
Tra i sintomi che identificano il manifestarsi della patologia artrosica, oltre alla degradazione cartilaginea, troviamo l’infiammazione dello spazio periarticolare, della sinovia, alterazioni dell’osso subcondrale come formazioni di sclerosi e formazioni di osteofiti (Jiang et al. 2014).
L’OA viene generalmente classificata in: primaria, o idiopatica e secondaria. Le patologie primarie vengono a loro volta suddivise in nodali e generalizzate, mentre le secondarie, che si sviluppano conseguentemente a specifiche cause, vengono suddivise in post-traumatiche e generalizzate (Kon et al. 2012).
L’artrosi primitiva è correlata all’età e si sviluppa soprattutto in anziani con articolazioni precedentemente intatte. L’artrosi secondaria invece si sviluppa anche in soggetti giovani a causa di uno o più fattori predisponenti noti che abbiano alterato la cartilagine articolare o l’osso subcondrale delle articolazioni colpite (Kon et al. 2012).
La prevalenza e l’incidenza dell’OA è strettamente legata all’età come conseguenza di alcune modificazioni biologiche legate all’invecchiamento, come la diminuzione della risposta condrocitaria ai fattori di crescita e l’aumento della lassità dei legamenti. Si è visto che la prevalenza dell’incidenza primaria in età inferiore ai 50 anni avviene a carico del sesso maschile, mentre dopo i 50 anni è il sesso femminile quello maggiormente colpito (Kon et al. 2012).
LA DEGENERAZIONE CARTILAGINEA E L’OSTEOARTROSI
L’osteoartrosi (OA) è tra le maggiori cause di disabilità e costituisce il problema più grande per la sanità pubblica nel secolo corrente (Honvo et al. 2020; Weber et al. 2020). Comunemente l’OA coinvolge soprattutto le articolazioni soggette al carico del peso e influisce considerevolmente sulla qualità della vita a causa del dolore cronico e delle limitazioni nella funzionalità articolare (Honvo et al. 2020).
Il processo che porta alla degradazione cartilaginea è costituito da molte variabili e si verifica con modalità e tempistiche estremamente varie. Al contrario, le cause sono riconducibili ad un numero limitato di eventi che attivano meccanismi degradativi i quali, agendo sulle componenti proteiche e glicidiche del tessuto, ne determinano la progressiva idrolisi (Kon et al. 2012).
Solitamente, alle alterazioni anatomiche corrisponde anche una modifica funzionale delle caratteristiche biomeccaniche del tessuto che causa una risposta inadeguata alle sollecitazioni meccaniche (Kon et al. 2012). L’OA e l’artrite reumatoide compromettono sia le caratteristiche strutturali sia quelle funzionali del tessuto cartilagineo (Kon et al. 2012).

Le lesioni del tessuto cartilagineo articolare, oltre che di natura puramente patologica, possono essere conseguenze di un evento traumatico, che poi, a causa della ridotta capacità rigenerativa di questo tessuto, si evolve nella patologia artrosica. Infatti, il naturale processo di riparazione cartilaginea porta alla formazione di tessuto fibrocartilagineo, con capacità meccaniche notevolmente inferiori. Inoltre, il meccanismo “auto-riparativo” viene completato solo nel caso di piccole perdite di sostanza, quelle di maggiori dimensioni, o che coinvolgono l’osso subcondrale, raramente vengono colmate spontaneamente (Kon et al. 2012).
La fisiopatologia della degenerazione articolare (Degenerative Joint Disease – DJD) implica vari fattori quali: l’età avanzata, sindromi metaboliche, mal-allineamenti relativi agli arti inferiori, traumi e infiammazioni sistemiche (Weber et al. 2020).
Il gold standard nella diagnosi dell’OA è la valutazione radiografica, ma è la risonanza magnetica (MRI), in particolare il metodo dGEMRIC (contrasto con gadolinio), che permette di valutare la trasformazione della cartilagine con il progredire della patologia (Weber et al. 2020).
Alcune molecole possono essere utilizzate come biomarker della patologia artrosica e un aumento nelle concentrazioni di biomarker quali interleuchina 6 (IL-6), interleuchina 8 (IL-8), metalloproteasi della matrice (MMPs), proteine della matrice oligomerica della cartilagine (COMP), fattori di necrosi tumorale (TNF) ed altri, presenti nel fluido sinoviale, sono stati associati all’attivazione di cascate molecolari che stimolano la degenerazione della cartilagine e contribuiscono allo sviluppo e al progredire dell’OA (Weber et al. 2020).
Alcuni biomarker specifici possono aiutare a individuare con successo gli individui ad alto rischio di OA, prevederne il decorso, in modo tale da aiutare lo sviluppo di test diagnostici e terapie personalizzate (Weber et al. 2020).
La gran parte dei biomarker analizzati in vari studi riguarda l’articolazione del ginocchio e al loro livello si associa la degenerazione cartilaginea (Weber et al. 2020).
L’OA è il risultato di un’alterazione sia dell’equilibrio metabolico tra cartilagine, membrana sinoviale e osso subcondrale, sia del metabolismo dei condrociti, che assumono funzione catabolica, producendo, insieme alla membrana sinoviale, alcuni mediatori della flogosi come le citochine pro-infiammatorie (Kon et al. 2012). Questi mediatori promuovono la degradazione della matrice extracellulare che, a sua volta, causa l’assottigliamento della cartilagine articolare e conseguentemente, un aumento della densità dell’osso subcondrale, in risposta all’aumentare del carico non più supportato dalla cartilagine progressivamente degenerata (Kon et al. 2012).
Tra i sintomi che identificano il manifestarsi della patologia artrosica, oltre alla degradazione cartilaginea, troviamo l’infiammazione dello spazio periarticolare, della sinovia, alterazioni dell’osso subcondrale come formazioni di sclerosi e formazioni di osteofiti (Jiang et al. 2014).
L’OA viene generalmente classificata in: primaria, o idiopatica e secondaria. Le patologie primarie vengono a loro volta suddivise in nodali e generalizzate, mentre le secondarie, che si sviluppano conseguentemente a specifiche cause, vengono suddivise in post-traumatiche e generalizzate (Kon et al. 2012).
L’artrosi primitiva è correlata all’età e si sviluppa soprattutto in anziani con articolazioni precedentemente intatte. L’artrosi secondaria invece si sviluppa anche in soggetti giovani a causa di uno o più fattori predisponenti noti che abbiano alterato la cartilagine articolare o l’osso subcondrale delle articolazioni colpite (Kon et al. 2012).
La prevalenza e l’incidenza dell’OA è strettamente legata all’età come conseguenza di alcune modificazioni biologiche legate all’invecchiamento, come la diminuzione della risposta condrocitaria ai fattori di crescita e l’aumento della lassità dei legamenti. Si è visto che la prevalenza dell’incidenza primaria in età inferiore ai 50 anni avviene a carico del sesso maschile, mentre dopo i 50 anni è il sesso femminile quello maggiormente colpito (Kon et al. 2012).
Classificazione
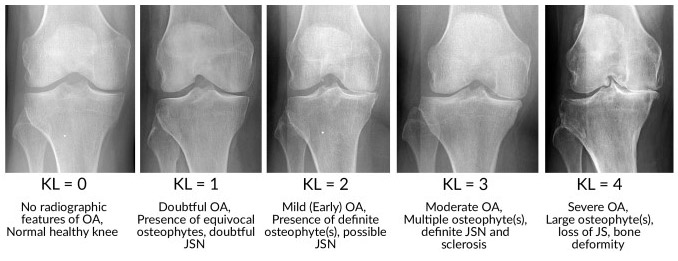
La classificazione più utilizzata è la classificazione modificata di Kellgren-Lawrence (K&L) per la classificazione radiografica, insieme alle scale di valutazione della sintomatologia: WOMAC, KOOS, HSS, OKS e KSS (Kohn et al. 2016; Raina et al. 2018).
La diagnosi di artrosi è complicata da diversi fattori, come la carenza di specifici segni fisici o laboratoristici e la discrepanza che talvolta si riscontra tra sintomatologia e radiografie (Raina et al. 2018).
In questo contesto la definizione clinica e radiologica di pre-artrosi è tanto problematica quanto importante. Alcuni definiscono pre-artrosi radiografica i gradi I e II K&L associati ad almeno 2 episodi dolorosi di 10 giorni nell’ultimo anno e ad alterazioni osteocartilaginee diagnosticate alla RM o artroscopicamente (Luyten et al. 2012).
I TENDINI
I tendini sono tessuti molli fibrosi che connettono i muscoli alle ossa. La loro principale funzione è trasferire la forza generata dai muscoli allo scheletro, facilitando il movimento delle articolazioni e resistendo a forze elevate, nonostante siano strutture tendenzialmente passive e non elastiche.
I tendini sono composti da triple eliche cross-linkate principalmente di collagene di tipo I, posizionate in maniera gerarchica parallelamente all’asse più lungo del tendine, in modo da avere una forte resistenza alla tensione. I tendini contengono anche un assortimento di proteine non collageniche presenti in bassa concentrazione ma con un importante ruolo funzionale (Weinreb et al. 2014; Thorpe & Screen 2016).
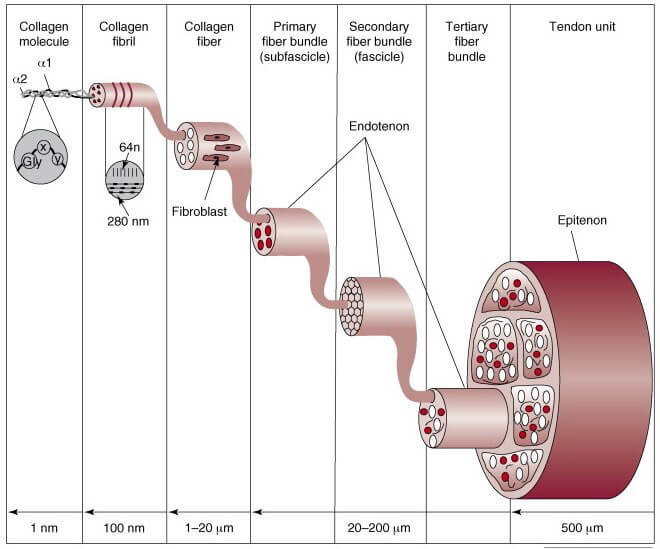
I tendini e i legamenti sono tessuti connettivi che guidano il movimento, distribuiscono il peso e trasmettono la forza in un modo unico a seconda del sito anatomico coinvolto e dello stress biomeccanico al quale sono sottoposti (Mienaltowski & Birk 2014). Il collagene è il maggior componente sia dei tendini che dei legamenti. La struttura gerarchica dei tendini e le loro proprietà funzionali sono determinate dal collagene presente e dalle molecole ad esso connesse. Differenti strutture di collagene e molecole ad esso associate determinano differenti strutture tendinee e funzioni differenti (Mienaltowski & Birk 2014; Weinreb et al. 2014).
Un cambiamento nella struttura e nella composizione dei tendini predispone all’insorgenza di tendinopatie, che includono disturbi da sovraccarico, problemi di natura meccanica e degenerativa, incluse le infiammazioni alle entesi (Weinreb et al. 2014).
Le patologie tendinee sono, insieme a quelle articolari, uno dei principali problemi. È noto infatti, che lesioni della cuffia dei rotatori contribuiscono alla comparsa dell’osteoartrosi di spalla, proprio per la funzione strutturale e fondamentale dei tendini nella coordinazione dei movimenti e nella distribuzione del peso. Pertanto è consigliabile curare al meglio la tendinopatia per scongiurare la comparsa di OA di spalla o minimizzarne la sintomatologia se a stadi iniziali (Ibrahim et al. 2019).
LA DEGENERAZIONE TENDINEA
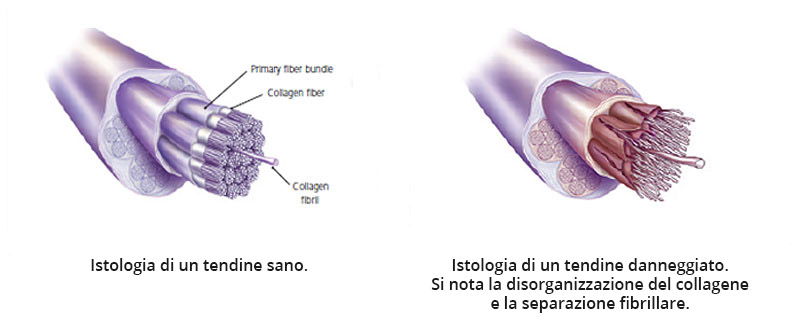
Il termine “tendinopatia” è un termine generico per indicare un tendine doloroso, con perdita di funzionalità e che presenta un cambiamento patologico nel tessuto (Ibrahim et al. 2019). Il termine “tendinosi” invece si utilizza per indicare la conferma istologica del cambiamento in termini degenerativi in assenza di cellule infiammatorie ma in cui siano presenti cambiamenti quali la disorganizzazione delle fibre di collagene, l’arrotondamento dei nuclei dei tenociti, l’ipervascolarità, l’aumento di glicosaminoglicani e la neovascolarizzazione nei campioni istologici (Ibrahim et al. 2019).
L’eziologia delle tendinopatie non è ancora stata completamente individuata, anche se il sovraccarico e il ridotto apporto ematico ai tendini possono essere considerati come i precursori del processo di degenerazione tendinea e quindi di insorgenza di una tendinopatia (Ibrahim et al. 2019).
Solitamente i tendini sani hanno una distribuzione bimodale del diametro delle fibre di collagene, in cui gli spazi lasciati dall’organizzazione delle fibre di diametro più grande vengono riempiti dalle fibre di diametro più piccolo, ottenendo sia un elevato contenuto di collagene, sia mantenendo la flessibilità del tessuto (Ibrahim et al. 2019). I tendini rotti hanno mostrato di contenere più fibre di piccolo diametro, rispetto ai tendini sani (Ibrahim et al. 2019).
I disturbi legati alla degenerazione tendinea sono molto frequenti nella popolazione mondiale. Le tendinopatie sono spesso associate alla degenerazione e alla disorganizzazione delle strutture collageniche con aumento di mucoidi, proteoglicani e contenuto di acqua (Weinreb et al. 2014). Cambiamenti chimici e molecolari includono la produzione di metalloproteasi di matrice, apoptosi delle cellule tendinee, metaplasia condroide del tendine e l’espressione di fattori protettivi che sono stati osservati in tendini soggetti al sovraccarico (Weinreb et al. 2014). I cambiamenti macroscopici consistono nell’ispessimento del tendine, nella perdita delle proprietà meccaniche e nel dolore (Weinreb et al. 2014). Possono presentarsi rotture a livello fibrillare e possono progredire fino alla rottura completa del tendine per tutto il suo spessore (Weinreb et al. 2014).
Con l’aumentare dell’età i tendini subiscono modificazioni a livello strutturale e nella composizione, come la diminuzione del contenuto d’acqua, cambiamenti nel collagene e diminuzione della vascolarità, che predispongono alla comparsa di tendinopatie ed entesiti infiammatorie (Weinreb et al. 2014).
Spesso l’OA di spalla è legata alla tendinopatia della cuffia dei rotatori, infatti si nota una degenerazione tendinea in pazienti con OA di spalla, rispetto a pazienti che non presentano patologia artrosica (Ibrahim et al. 2019). Agire sulla tendinopatia in forma precoce potrebbe quindi essere preventivo nei confronti della successiva patologia artrosica (Ibrahim et al. 2019).
TRATTAMENTI DELL’OA SINTOMATICA
Le strategie più utilizzate nella gestione dell’OA consistono in combinazioni di trattamenti farmacologici e non, orali e/o infiltrativi, aventi lo scopo di ridurre il dolore e aumentare le funzionalità fisiche del paziente, migliorandone la qualità della vita. I trattamenti più utilizzati sono stati il paracetamolo e i farmaci antinfiammatori non steroidei. Recentemente vari report hanno dimostrato l’insorgenza di numerosi effetti collaterali, la non completa sicurezza di questi farmaci e lunghi tempi di risposta, portando quindi a una drastica limitazione nel loro utilizzo e a preferire trattamenti alternativi come: supplementazione orale, terapia fisica riabilitativa o viscosupplementazione (De Luca et al. 2019; Ibrahim et al. 2019; Honvo et al. 2020).
Data la natura degenerativa della patologia artrosica, che porta alla progressiva degradazione della cartilagine, è stato postulato che la supplementazione con collagene idrolizzato possa stimolare i condrociti alla sintesi di matrice cartilaginea, fornendo le catene amminoacidiche primarie necessarie (De Luca et al. 2019; Ibrahim et al. 2019; Honvo et al. 2020). Infatti, vari studi hanno dimostrato che i peptidi di collagene idrolizzato assunti per via orale si depositano e si accumulano nei tessuti cartilaginei poche ore dopo l’assunzione (Ibrahim et al. 2019; Honvo et al. 2020).
I trattamenti correnti per l’OA sintomatica comprendono la terapia infiltrativa, la terapia fisica riabilitativa, il controllo del peso e interventi chirurgici per la correzione di malallineamenti (Weber et al. 2020).
La terapia locale infiltrativa con antinfiammatori, molecole affini alla cartilagine o cellule staminali adulte, ha dimostrato di portare ad un miglioramento nella sintomatologia dolorosa e nella funzionalità articolare in pazienti con OA (Weber et al. 2020).
La terapia infiltrativa più utilizzata è quella riguardante i fattori di crescita autologhi ad elevate concentrazioni poiché grazie alla loro interazione con i tessuti promuovono la sintesi di pathway molecolari endogeni che regolano la rigenerazione cartilaginea, interrompendo l’infiammazione e quindi migliorando sensibilmente la sintomatologia e la funzionalità articolare (Weber et al. 2020). Il collagene idrolizzato somministrato per os o per via infiltrativa si colloca su un piano di azione simile, fornendo le catene amminoacidiche primarie necessarie ai condrociti per la sintesi di matrice extracellulare e collagene, contrastando il meccanismo di degradazione causato dall’infiammazione che si instaura con la comparsa della patologia artrosica (De Luca et al. 2019). Con il manifestarsi dell’OA infatti, vengono espressi i mediatori dell’infiammazione, come le interleuchine (IL-1, IL-6) e il TNF, che a loro volta attivano gli enzimi degradanti la cartilagine, come le metalloproteasi di matrice (MMPs). L’apporto di collagene idrolizzato permette di sopperire alla degradazione causata dalla patologia artrosica e di minimizzarne gli effetti, mantenendo stabile il comparto articolare nel lungo periodo (De Luca et al. 2019).
IL COLLAGENE
Il collagene è una proteina che si trova nel tessuto connettivo come pelle, ossa, cartilagine e tendini e costituisce circa il 30% delle proteine del corpo umano (Yamamoto et al. 2016; Porfirio & Fanaro 2016; Léon-Lòpez et al. 2019).
In natura il collagene è formato da catene peptidiche estremamente lunghe che possono raggiungere un peso molecolare di parecchie centinaia di kDa. La molecola di collagene ha una composizione amminoacidica molto specifica, che consiste di circa 1000 glicine, 360 proline e 300 idrossiproline, queste ultime assenti in qualsiasi altra proteina.
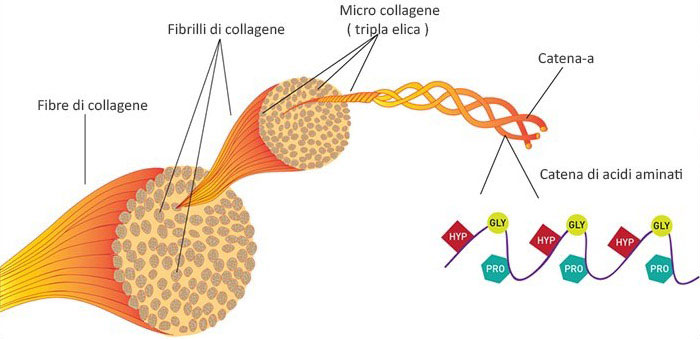
Il nostro organismo è in grado di sintetizzare direttamente solo glicina e prolina, mentre l’idrossiprolina viene sintetizzata indirettamente per idrolisi. Dati i numeri degli aminoacidi necessari alla costituzione di una singola molecola di collagene si può immaginare quale sia lo sforzo di sintesi di tutto il collagene presente nell’organismo umano, che costituisce il 6% del peso corporeo totale (Kon et al. 2012; Porfirio & Fanaro 2016).
Il collagene è una proteina strutturale che forma una vera e propria impalcatura di sostegno per numerosi organi e tessuti (Kon et al. 2012).
La disposizione più stabile del collagene è a tripla elica, proprio grazie alla presenza della prolina. L’unità strutturale del collagene è rappresentata dal tropocollagene, formata da tre catene polipeptidiche associate (Kon et al. 2012; Léon-Lòpez et al. 2019).
Dal punto di vista del valore nutrizionale, il collagene non viene considerato come una proteina di alta qualità, a causa della mancanza di amminoacidi essenziali quali triptofano, metionine, cisteine e triosine. Invece, ha un elevato potere nutrizionale proprio grazie alla particolare composizione amminoacidica che stimola la sintesi di collagene nella cartilagine articolare e della matrice extracellulare nei vari tessuti (Porfirio & Fanaro 2016; Léon-Lòpez et al. 2019).
Le molecole di collagene sono i principali costituenti della matrice cartilaginea e si trova soprattutto nelle seguenti isoforme: di tipo II, nella maggioranza, V, VI, IX, X e XI. Queste isoforme si organizzano in una struttura a tripla elica che coinvolge la maggior parte della sequenza polipeptidica (Kon et al. 2012).
La disposizione e la struttura delle fibre di collagene è fondamentale all’interno delle varie zone della cartilagine articolare nella gestione delle forze a cui è sottoposta e soprattutto nella risposta alle forze di taglio, grazie alla resistenza alla torsione e alla tensione. Sono soprattutto le fibre nella zona intermedia, con un orientamento apparentemente casuale, che permettono alla cartilagine un certo grado di deformazione, senza alcuna fuoriuscita di liquidi. Quando la cartilagine è sottoposta a forze di taglio la componente solida viene direttamente coinvolta nella risposta biomeccanica andando incontro ad usura (Kon et al. 2012).
IL COLLAGENE IDROLIZZATO
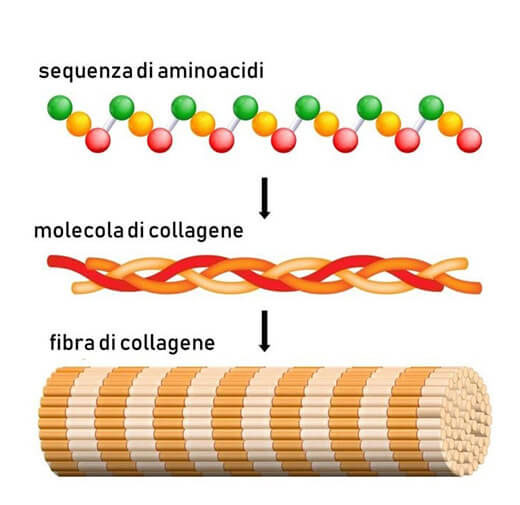
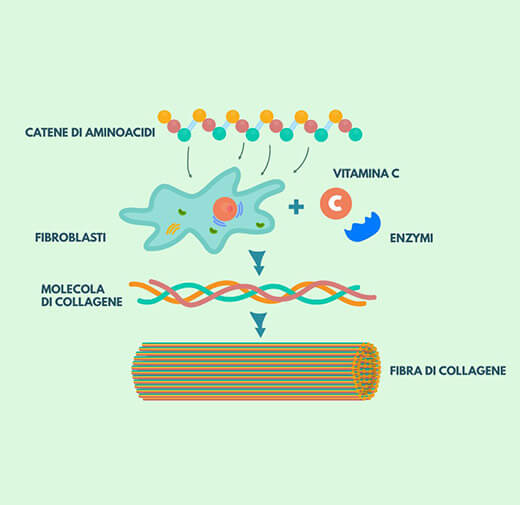
Il collagene idrolizzato (CH) è prodotto a partire da collagene di origine animale sottoposto ad un processo di idrolisi enzimatica con successive filtrazioni e purificazioni. Si ottengono corte catene peptidiche, con un basso peso molecolare contenenti elevati quantitativi di idrossiproline, glicine e proline (Jiang et al. 2014; Kumar et al. 2015; Yamamoto et al. 2016; Porfirio & Fanaro 2016).
La sequenza primaria della catena peptidica del collagene è unica, in quanto la glicina si ripete ogni tre residui, formando la sequenza (Gly-X-Y)n; la sequenza che si verifica più di frequente è Gly-Pro-Hyp (Yamamoto et al. 2016). È proprio la dimensione di queste catene peptidiche a rendere il collagene idrolizzato estremamente biodisponibile e fisiologicamente attivo (Kumar et al. 2015; Yamamoto et al. 2016; Porfirio & Fanaro 2016).
È noto che tripeptidi come le sequenze Gly-Pro-Hyp interagiscono con le piastrine agendo sul sistema nervoso centrale, mentre dipeptidi come Pro-Hyp promuovono la sintesi di acido ialuronico e la formazione di cartilagine articolare (Yamamoto et al. 2016). Altri dipeptidi come Pro-Hyp e Hyp-Gly inibiscono il TNF (Tumor Necrosis Factor), responsabile dell’induzione della risposta infiammatoria (Yamamoto et al. 2016).
I vari benefici osservati in seguito ad assunzione di collagene idrolizzato sono correlati alla metabolizzazione dei peptidi che lo compongono (Yamamoto et al. 2016).
Gli idrolizzati di collagene, assunti per via orale, subiscono varie reazioni di degradazione nel tratto digerente e vengono assorbiti principalmente come amminoacidi, dipeptidi o tripeptidi. In particolare, dipeptidi e tripeptidi vengono assorbiti direttamente tramite il trasportatore peptidico PEPT1 presente sui villi della mucosa intestinale. Pertanto, la forma di collagene idrolizzato ideale per massimizzare l’efficienza di assorbimento e la concentrazione di peptidi metabolizzati nel sangue è quella in cui le molecole siano già in forma di tripeptidi e dipeptidi, un idrolizzato di collagene quindi a basso peso molecolare (Yamamoto et al. 2016; Porfirio & Fanaro 2016).
È stato dimostrato da vari studi che i peptidi a basso peso molecolare, dopo l’assorbimento intestinale si accumulano soprattutto nella cartilagine e nelle ossa (Porfirio & Fanaro 2016).
Da molto tempo sono noti i benefici apportati alle articolazioni dall’assunzione orale di collagene idrolizzato nel trattamento dell’OA. L’assunzione orale è il principale metodo di utilizzo del collagene idrolizzato, anche se da qualche tempo sono presenti sul mercato formulazioni iniettabili, studiate ad hoc per l’iniezione intra e periarticolare.
I peptidi a basso peso molecolare da collagene idrolizzato sono peptidi funzionali e presentano varie attività fisiologiche, che migliorano la funzionalità articolare, la sintomatologia dolorosa, la densità minerale delle ossa, oltre che apportare vari benefici a pelle, capelli e unghie (Kumar et al. 2015; García-Coronado et al. 2019).
Il collagene idrolizzato, accumulandosi nelle articolazioni a livello cartilagineo, fornisce le componenti amminoacidiche necessarie alla sintesi delle macromolecole costituenti la matrice extracellulare, promuovendone la sintesi e contrastandone la degradazione (Jiang et al. 2014; Kumar et al. 2015; García-Coronado et al. 2019). Infatti, è stato dimostrato che quando la membrana sinoviale e i condrociti vengono esposti a collagene idrolizzato incrementano la sintesi di acido ialuronico, di collagene di tipo II e diminuiscono la secrezione di mediatori dell’infiammazione e di collagene di tipo I (De Luca et al. 2019; Volpi et al. 2020).
Sono proprio la glicina e la prolina, i principali amminoacidi presenti nel collagene idrolizzato a basso peso molecolare, ad essere fondamentali per la stabilità e la rigenerazione della cartilagine (Porfirio & Fanaro 2016).
Data la natura ubiquitaria del collagene, fino a questo momento il collagene idrolizzato è stato utilizzato soprattutto come integratore alimentare a supporto della terapia fisica riabilitativa, per contrastare il progredire della patologia artrosica a carico delle grandi articolazioni, migliorare la condizione di vita del paziente e per il mantenimento e la cura delle strutture tendineo-legamentose periarticolari (Jiang et al. 2014; Kumar et al. 2015; García-Coronado et al. 2019; Ibrahim et al. 2019). Recentemente è stata proposta anche la formulazione per iniezione intra-articolare e periarticolare per contrastare in maniera mirata la patologia artrosica e la degenerazione dei tessuti molli (De Luca et al. 2019; Volpi et al. 2020).
CHONDROVITA e CHONDROGRID®: DUE FORME DI COLLAGENE IDROLIZZATO
CHONDROVITA
CHondroVITA è un integratore alimentare a base di collagene idrolizzato di origine animale, altamente purificato. La sua formulazione è costituita da bustine monodose di 12 g, di cui 10 g sono di collagene idrolizzato. Ogni scatola contiene 30 bustine, per un trattamento di almeno 30 giorni consecutivi, in modo da favorire il bioaccumulo del collagene idrolizzato a livello dei vari distretti articolari sintomatici.
Solitamente, per favorire il bioaccumulo, è consigliato un trattamento di tre mesi consecutivi.
10 g di collagene idrolizzato è un quantitativo studiato per permettere al prodotto di raggiungere i vari distretti articolari dopo aver superato la fase digestiva e la barriera intestinale. Dosaggi inferiori infatti non garantiscono che il prodotto arrivi a destinazione in quantità sufficienti a fornire un beneficio.
CHondroVITA non presenta controindicazioni, ad esclusione di soggetti con ipersensibilità al collagene, e l’assenza di derivati del latte, glutine, zuccheri, grassi e colesterolo lo rendono adatto a tutti, anche a pazienti diabetici e cardiopatici.
Il collagene idrolizzato contenuto in CHondroVITA è prodotto da Gelita® a partire da collagene di origine animale, sottoposto ad un processo di idrolisi enzimatica, filtrazione e purificazione.
Il collagene idrolizzato è composto da corte stringhe peptidiche: analisi cromatografiche hanno dimostrato come il loro peso molecolare sia compreso tra 0,5 e 15 kDa, con un peso molecolare medio di circa 3,3 kDa. L’alta biodisponibilità e la capacità di accumulo a livello articolare sono proprio dovute al basso peso molecolare.
CHondroVITA è indicato per pazienti di tutte le età, sia come supporto alla terapia fisica riabilitativa o infiltrativa locale, sia come primo rimedio contro i primi sintomi di rigidità e dolore articolare, sia per sportivi che intendano preservare al meglio l’elasticità, la morfologia e la funzionalità articolare e periarticolare. È indicato inoltre per il mantenimento articolare in seguito a traumi o episodi di infiammazione dovuti al sovraccarico.
È stato infatti dimostrato da uno studio in vitro che condrociti coltivati in un medium a base di CHondroGrid® sono stimolati alla produzione di collagene di tipo II (+20%) a fronte di una diminuzione di collagene di tipo I, rispetto al controllo in assenza di CHondroGrid® (De Luca et al. 2019). Nello stesso studio condotto da De Luca et al. (2019) è stata dimostrata anche la sicurezza di CHondroGrid® in merito a biocompatibilità, non citotossicità e sicurezza del prodotto somministrato mediante iniezione intra-articolare. La somministrazione di CHondroGrid® per via intra-articolare ha anche evidenziato la capacità del collagene idrolizzato di inibire la sintesi di molecole proinfiammatorie, arrestando la catena dell’infiammazione e quindi interferendo con il meccanismo a cascata che provoca la degradazione della cartilagine articolare in articolazioni affette da OA. Questo permette di mantenere ad un livello stabile il più a lungo possibile il comparto articolare affetto da OA, scoraggiando il rapido avanzare della patologia verso gradi più severi (De Luca et al. 2019; Volpi et al. 2020).
CHONDROGRID®
CHondroGrid® è un dispositivo medico composto da collagene idrolizzato a basso peso molecolare, appositamente formulato per l’iniezione intra-articolare e periarticolare. L’origine del collagene è la medesima del prodotto CHondroVITA, di cui è l’evoluzione. Il processo di idrolisi, di filtrazione, di purificazione, di disidratazione e di successiva sterilizzazione a raggi beta permettono di ottenere peptidi a basso peso molecolare (peso medio di circa 3 kDa) estremamente stabili, biocompatibili e altamente biodisponibili, grazie alla loro dimensione. La liofilizzazione e la sterilizzazione a raggi beta garantiscono un prodotto stabile, conservabile a temperatura ambiente e che non perde le sue caratteristiche.
La formulazione di CHondroGrid® prevede un dosaggio di 4 mg di collagene idrolizzato da risospendere in 2 ml di acqua apirogena sterile, garantendo un elevato apporto di peptidi a basso peso molecolare nella sede di infiltrazione.
L’elevato apporto di peptidi (4 mg) è necessario per avere una risposta in termini di diminuzione della sintomatologia dolorosa e miglioramento della funzionalità articolare, in quanto le catene collageniche che costituiscono la cartilagine articolare necessitano di un’elevatissima quantità di amminoacidi quali glicine e proline per essere sintetizzate.
L’OA, che normalmente causa la degradazione del collagene, può quindi essere stabilizzata e rallentata da questo elevato apporto di peptidi che fornisce le componenti amminoacidiche necessarie ai condrociti per la sintesi di nuovo collagene e matrice extracellulare.

INDICAZIONI D’USO e POSOLOGIA
CHondroGrid® è indicato per il trattamento dell’OA sintomatica di ginocchio dal grado 1 al grado 4 KL e per il trattamento di articolazioni sintomatiche sia con infiltrazioni intra-articolari che periarticolari. CHondroGrid® è infatti indicato per l’utilizzo intra-articolare per il trattamento a livello cartilagineo e per il trattamento tendineo-legamentoso relativo all’ambiente periarticolare.
Il numero dei trattamenti, con un massimo di tre infiltrazioni, viene stabilito dal Medico sulla base del grado di severità della patologia.
Il trattamento con CHondroGrid® prevede tre iniezioni a 0, 15 e 45 giorni dalla prima per quanto riguarda iniezioni intra-articolari e periarticolari. Un ciclo infiltrativo si compone di tre infiltrazioni, ciascuna costituita da 4 mg di collagene idrolizzato solubilizzati in 2 ml di acqua apirogena sterile. La preparazione avviene in totale sicurezza e nella confezione si trova tutto il necessario per la preparazione e l’iniezione.
Il numero di trattamenti e il quantitativo fornito da ciascuna infiltrazione garantiscono un elevato apporto di peptidi di collagene idrolizzato e quindi il mantenimento dello stimolo cellulare alla sintesi di collagene di tipo II, con la conseguente interruzione della catena infiammatoria, le cui concause principali sono: la degradazione della cartilagine articolare, nel comparto articolare, e l’assottigliamento tendineo in ambiente peri-articolare.
RISULTATI CLINICI
Le prime informazioni riguardanti i benefici dell’assunzione di collagene e dei suoi derivati, quali gelatine o idrolizzati, risalgono al XII secolo. È noto infatti che l’assunzione continuativa di collagene e in particolare idrolizzato di collagene a basso peso molecolare, riduca la sintomatologia dolorosa a carico delle principali articolazioni e dei tendini maggiormente soggetti a sovraccarico e usura, migliori l’elasticità cutanea e il generale aspetto di unghie e capelli.
Tra i primi studi sul collagene idrolizzato assunto per via orale c’è lo studio di Krug (1979) che nota la sensibile riduzione della sintomatologia dolorosa di varie articolazioni osteoartrosiche in 193 pazienti. Nel tempo sono numerosi gli studi condotti sul collagene idrolizzato assunto per via orale, che attestano miglioramenti significativi nella sintomatologia dolorosa di articolazioni osteoartrosiche, sia negli umani che negli animali, riducendo l’utilizzo di analgesici e antinfiammatori.
Jiang et al. nel 2014 attestano che uno studio in doppio cieco sulla supplementazione orale con collagene idrolizzato ha significativi benefici nel trattamento della sintomatologia e nel miglioramento della funzionalità articolare in ginocchia con osteoartrosi media. L’assenza di effetti collaterali e la sicurezza del prodotto lo rendono un ottimo prodotto per il trattamento dell’osteoartrosi.
Numerosi studi successivi confermano ulteriormente come l’assunzione di collagene idrolizzato a basso peso molecolare aiuti a prevenire l’osteoporosi e dunque anche la patologia artrosica, che in molti casi è la sua diretta conseguenza (Porfirio & Fanaro 2016).
Infatti, vari studi dimostrano che sia il basso peso molecolare del collagene idrolizzato a permettere la sua interazione con osteoblasti e osteoclasti, mantenendo l’equilibrio tra sintesi e disgregazione, incrementando la crescita e il differenziamento di osteoblasti e riducendo il numero di osteoclasti (Porfirio & Fanaro 2016).
A questo proposito, lo studio di Czajka et al. (2018) evidenzia come l’assunzione giornaliera di 10 g di collagene idrolizzato per 6-12 mesi porti ad un aumento della struttura della cartilagine articolare umana, confermato anche dall’imaging dGEMRIC. L’assunzione orale di collagene idrolizzato sembra quindi arrestare la progressione della patologia artrosica.
Vari studi condotti parallelamente su animali hanno dimostrato come i peptidi a basso peso molecolare da collagene idrolizzato riducono i cambiamenti morfologici associati alla degradazione cartilaginea delle articolazioni affette da OA, soprattutto di ginocchio, migliorando sensibilmente la sintomatologia dolorosa che ne deriva (Kumar et al. 2015; García-Coronado et al. 2019).
Il più recente studio effettuato da Volpi et al. (2020) su 70 pazienti trattati con infiltrazioni intra-articolari di CHondroGrid®, ha evidenziato mediante la scala WOMAC una riduzione del dolore pari all’80%, una riduzione del 50% per quanto riguarda la rigidità articolare, una riduzione del 63% nell’impedimento funzionale e una riduzione complessiva della scala WOMAC pari al 64%.
I pazienti trattati con CHondroGrid® attestano un miglioramento significativo nella funzionalità articolare, nella sintomatologia dolorosa e in tutti i parametri della scala WOMAC (De Luca et al. 2019; Volpi et al. 2020).
CHondroGrid® presenta dunque un’altra possibilità di trattamento, intra e periarticolare, rispetto all’assunzione per via orale, utilizzata fino ad ora. CHondroGrid® è un dispositivo medico che fornisce alla popolazione condrocitaria presente in articolazione gli stessi peptidi che normalmente vengono impiegati nella sintesi della matrice extracellulare e del collagene. In questo modo i condrociti vengono stimolati alla produzione di collagene di tipo II, così da conservare il più possibile le proprietà elastiche e meccaniche della cartilagine nativa, senza che i tentativi di riparazione cartilaginea autogena portino alla formazione di collagene di tipo I e quindi ad una cartilagine più rigida e con caratteristiche più distanti da quella nativa (De Luca et al. 2019).
Gli studi effettuati sulla somministrazione per via intra-articolare di CHondroGrid® dimostrano che vengono significativamente ridotti i punteggi VAS, Lequesne e WOMAC. I risultati sono decisamente migliori di quelli ottenuti da Furuzawa et al. (2009-2012) e Martin Martin et al. (2016) riguardanti iniezioni intra-articolari di collagene di tipo I polimerizzato (De Luca et al. 2019; Volpi et al. 2020).
Lo studio in vitro di De Luca et al. (2019) evidenzia come condrociti coltivati in medium a cui è stato aggiunto collagene idrolizzato, in questo caso CHondroGrid®, siano stimolati ad una sintesi maggiore di collagene di tipo II con inibizione della sintesi di collagene di tipo I. Al contrario, condrociti coltivati in medium normale sintetizzano normalmente soprattutto collagene di tipo I e una minima parte di collagene di tipo II. I condrociti coltivati con medium con collagene idrolizzato (CHondroGrid®) presentano una densità cellulare minore, una deposizione maggiore di matrice extracellulare, un punteggio morfologico più alto e una forma cellulare più rotonda (De Luca et al. 2019). Inoltre, non è stata rilevata alcuna citotossicità di CHondroGrid® nei confronti dei condrociti, se non in dosi superiori a 1,5 mg/ml fornite per 6 giorni continuativi (De Luca et al. 2019).
CONCLUSIONI
Il collagene idrolizzato (CH) ha un ruolo positivo nella cura e nella gestione dell’osteoporosi e dell’osteoartrosi, soprattutto a carico dell’articolazione del ginocchio. Il CH, infatti, aiuta ad incrementare la densità minerale delle ossa, ha un effetto protettivo sulla cartilagine articolare e interrompe la sintomatologia dolorosa a carico delle articolazioni (Porfirio & Fanaro 2016).
Il collagene idrolizzato per essere altamente biodisponibile deve essere nella forma a minor peso molecolare possibile, poiché sono dipeptidi e tripeptidi ad essere assorbiti a livello intestinale e metabolizzati nel sangue (Yamamoto et al. 2016).
È stato inoltre dimostrato che gli effetti biologici derivati dall’assunzione di collagene idrolizzato a basso peso molecolare sono dose-dipendenti, pertanto un elevato dosaggio e un basso peso molecolare favoriscono l’assorbimento e l’attività biologica dei peptidi (Yamamoto et al. 2016).
CHONDROVITA è un integratore alimentare che fornisce 10 g al giorno per 30 giorni di peptidi a basso peso molecolare da collagene idrolizzato. Questo dosaggio, unito al basso peso molecolare permettono di alleviare la sintomatologia dolorosa a carico delle articolazioni, migliorare la funzionalità articolare e aiutare il mantenimento del comparto articolare, rallentando la progressione della patologia artrosica.
CHondroGrid® è un dispositivo medico iniettabile a base di peptidi a basso peso molecolare da collagene idrolizzato, nel quantitativo di 4 mg disciolti in 2 ml, sicuro e utile nel trattamento di patologie articolari e periarticolari soprattutto a carico di ginocchio e spalla (De Luca et al. 2019; Volpi et al. 2020).
È dimostrato che CHondroGrid® stimola i condrociti alla produzione di cartilagine ialina e permette di bilanciare la normale risposta riparativa, che porterebbe alla deposizione di collagene di tipo I e quindi alla formazione di cartilagine fibrosa (De Luca et al. 2019). Lo studio di Volpi et al. (2020) rafforza queste conclusioni dimostrando come il dosaggio di CHondroGrid® (4 mg) e il basso peso molecolare dei peptidi che lo costituiscono (< 3 kDa) lo rendano un sicuro ed efficace metodo di trattamento della patologia artrosica di ginocchio dal grado 1 KL al grado 4 KL, nel medio periodo.
I peptidi a basso peso molecolare da collagene idrolizzato possono quindi essere considerati un valido metodo di trattamento per la patologia artrosica e per l’ambiente periarticolare, portando ad un minor utilizzo di farmaci antidolorifici e antinfiammatori e migliorando sensibilmente la qualità della vita dei pazienti, in completa sicurezza.
Redazione scientifica: Dott.ssa Carlotta Boschian
BIBLIOGRAFIA
- Kon, E., Berruto, M., Condello, V., Peretti, G. M., & Ronga, M. A. R. I. O. (2012). Cartilagine: Istruzioni per l’uso.
- Ibrahim, M., Kartus, J. T., Steigen, S. E., Olsen, R., & Meknas, K. (2019). More tendon degeneration in patients with shoulder osteoarthritis. Knee Surgery, Sports Traumatology, Arthroscopy, 27(1), 267-275.
- Weber, A. E., Bolia, I. K., & Trasolini, N. A. (2020). Biological strategies for osteoarthritis: from early diagnosis to treatment. International Orthopaedics, 1-10.
- Mienaltowski, M. J., & Birk, D. E. (2014). Structure, physiology, and biochemistry of collagens. In Progress in heritable soft connective tissue diseases (pp. 5-29). Springer, Dordrecht.
- Thorpe, C. T., & Screen, H. R. (2016). Tendon structure and composition. In Metabolic influences on risk for tendon disorders (pp. 3-10). Springer, Cham.
- Weinreb, J. H., Sheth, C., Apostolakos, J., McCarthy, M. B., Barden, B., Cote, M. P., & Mazzocca, A. D. (2014). Tendon structure, disease, and imaging. Muscles, ligaments and tendons journal, 4(1), 66.
- Honvo, G., Lengelé, L., Charles, A., Reginster, J. Y., & Bruyère, O. (2020). Role of Collagen Derivatives in Osteoarthritis and Cartilage Repair: A Systematic Scoping Review With Evidence Mapping. Rheumatology and Therapy, 1-38.
- Kumar, S., Sugihara, F., Suzuki, K., Inoue, N., & Venkateswarathirukumara, S. (2015). A double‐blind, placebo‐controlled, randomised, clinical study on the effectiveness of collagen peptide on osteoarthritis. Journal of the Science of Food and Agriculture, 95(4), 702-707.
- Volpi, P., Zini, R., Erschbaumer, F., Beggio, M., Busilacchi, A., & Carimati, G. (2020). Effectiveness of a novel hydrolyzed collagen formulation in treating patients with symptomatic knee osteoarthritis: a multicentric retrospective clinical study. International Orthopaedics.
- De Luca, P., Colombini, A., Carimati, G., Beggio, M., de Girolamo, L., & Volpi, P. (2019). Intra-Articular Injection of Hydrolyzed Collagen to Treat Symptoms of Knee Osteoarthritis. A Functional In Vitro Investigation and a Pilot Retrospective Clinical Study. Journal of clinical medicine, 8(7), 975.
- Martin Martin LS, Massafra U, Bizzi E, Migliore A (2016) A double blind randomized active-controlled clinical trial on the intraarticular use of Md-Knee versus sodium hyaluronate in patients with knee osteoarthritis (“Joint”). BMC Musculoskelet Disord 17: 94. https://doi.org/10.1186/s12891-016-0948-4.
- Furuzawa-Carballeda J, Lima G, Llorente L, Nuñez-Álvarez C, Ruiz-Ordaz BH, Echevarría-Zuno S, Hernández-Cuevas V (2012) Polymerized-type I collagen downregulates inflammation and improves clinical outcomes in patients with symptomatic knee osteoarthritis following arthroscopic lavage: a randomized, double-blind, and placebo-controlled clinical trial. ScientificWorld Journal 2012: 342854. https://doi.org/10.1100/2012/342854.
- Jiang, J. X., Yu, S., Huang, Q. R., Zhang, X. L., Zhang, C. Q., Zhou, J. L., & Prawitt, J. (2014). Collagen peptides improve knee osteoarthritis in elderly women: A 6-month randomized, double-blind, placebo-controlled study. Agro Food Industry Hi Tech, 25(2), 19-23.
- Oláh T., Kamarul T., Madry H., Murali M.R. (2020) The Illustrative Anatomy and the Histology of the Healthy Hyaline Cartilage. In: Goyal D.R. (eds) The Illustrative Book of Cartilage Repair. Springer, Cham. https://doi.org/10.1007/978-3-030-47154-5_2
- Czajka, A., Kania, E. M., Genovese, L., Corbo, A., Merone, G., Luci, C., & Sibilla, S. (2018). Daily oral supplementation with collagen peptides combined with vitamins and other bioactive compounds improves skin elasticity and has a beneficial effect on joint and general wellbeing. Nutrition Research, 57, 97-108.
- García-Coronado, J. M., Martínez-Olvera, L., Elizondo-Omaña, R. E., Acosta-Olivo, C. A., Vilchez-Cavazos, F., Simental-Mendía, L. E., & Simental-Mendía, M. (2019). Effect of collagen supplementation on osteoarthritis symptoms: A meta-analysis of randomized placebo-controlled trials. International Orthopaedics, 43(3), 531-538.
- Yamamoto, S., Deguchi, K., Onuma, M., Numata, N., & Sakai, Y. (2016). Absorption and urinary excretion of peptides after collagen tripeptide ingestion in humans. Biological and Pharmaceutical Bulletin, 39(3), 428-434.
- Porfírio, E., & Fanaro, G. B. (2016). Collagen supplementation as a complementary therapy for the prevention and treatment of osteoporosis and osteoarthritis: a systematic review. Revista Brasileira de Geriatria e Gerontologia, 19(1), 153-164.
- Kohn, M. D., Sassoon, A. A., & Fernando, N. D. (2016). Classifications in brief: Kellgren-Lawrence classification of osteoarthritis. Clinical Orthopaedics and Related Research®, 474(8), 1886-1893.
- Luyten, F. P., Denti, M., Filardo, G., Kon, E., & Engebretsen, L. (2012). Definition and classification of early osteoarthritis of the knee. Knee Surgery, Sports Traumatology, Arthroscopy, 20(3), 401-406.
- Raina, P., & Kalia, R. B. (2018). Osteoarthrosis knee: Need for a simplified prognostic knee score. Journal of Arthroscopy and Joint Surgery, 5(1), 33-41.
- León-López, A., Morales-Peñaloza, A., Martínez-Juárez, VM, Vargas-Torres, A., Zeugolis, DI e Aguirre-Álvarez, G. (2019). Collagene idrolizzato: fonti e applicazioni. Molecole , 24 (22), 4031.